
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下1.12L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为4.8g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | 浓度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
| ③ |
分析 根据溶液为澄清溶液可知:溶液中含有的离子一定能够能大量共存;由实验Ⅰ可知,该溶液中一定含有CO32-,其浓度为$\frac{\frac{1.12}{22.4}}{0.1}$=0.5mol/L,则一定没有Al3+、Mg2+、Ba2+、Fe3+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,硅酸加热分解生成二氧化硅,固体质量为4.8g为二氧化硅的质量,根据硅原子守恒,SiO32-的浓度为$\frac{\frac{4.8}{60}}{0.1}$=0.8mol/L;由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)+c(Cl-)=2×0.5mol/L+2×0.8mol/L+0.5mol/L=3.1mol/L,溶液中一定含有K+,且其浓度至少为3.1mol/L,不能确定OH-、NO3-是否存在,据此进行解答.
解答 解:根据溶液为澄清溶液可知:溶液中含有的离子一定能够能大量共存;由实验Ⅰ可知,该溶液中一定含有CO32-,其浓度为$\frac{\frac{1.12}{22.4}}{0.1}$=0.5mol/L,则一定没有Al3+ Mg2+ Ba2+ Fe3+;由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,硅酸加热分解生成二氧化硅,固体质量为4.8g为二氧化硅的质量,根据硅原子守恒,SiO32-的浓度为$\frac{\frac{4.8}{60}}{0.1}$=0.8mol/L;由实验Ⅲ可知溶液中不含SO42-,根据电荷守恒2c(CO32-)+2c(SiO32-)=2×0.5mol/L+2×0.8mol/L=3.1mol/L,溶液中一定含有K+,且其浓度至少为3.1mol/L,不能确定OH-、NO3-是否存在,
(1)通过以上实验不能确定是否存在的离子有OH-、NO3-,确定一定不存在的离子是Al3+、Mg2+、Ba2+、Fe3+、SO42-;
故答案为:OH-、NO3-;Al3+、Mg2+、Ba2+、Fe3+、SO42-;
(2)由生成白色沉淀判断溶液中一定含有SiO32-,发生反应SiO32-+2H+=H2SiO3↓,
故答案为:SiO32-+2H+=H2SiO3↓;
(3)根据以上计算可知,c(CO32-)=0.5mol/L,c(SiO32-)=0.8mol/L,一定不存在硫酸根离子,所c(SO42-)=0,
故答案为:
| 阴离子 | 浓度c/(mol•L-1) |
| ①CO32- | 0.5mol/L |
| ②SiO32- | 0.8mol/L |
点评 本题考查离子共存、离子检验及相关物质的量浓度的计算,难度较大.注意掌握离子反应反应条件及常见离子的检验方法,根据电荷守恒判断K+是否存在,是本题的难点、易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
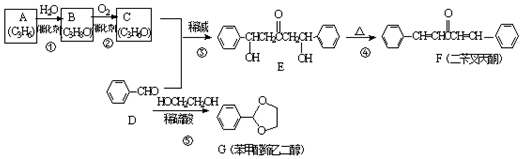
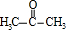 ;A加聚产物的结构简式是
;A加聚产物的结构简式是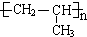 .
.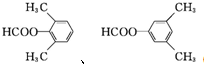 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
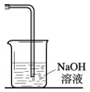 实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答
实验室常用以下方法制取氯气:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种 | B. | 三种 | C. | 四种 | D. | 五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com