
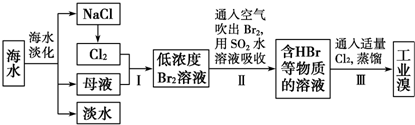
| ||
| 1L |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
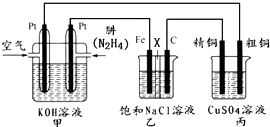
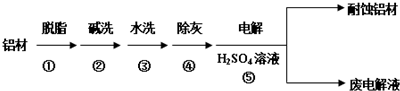
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | ||||
| B、铜片与浓HNO3反应:Cu+NO3-+2H+═Cu2++NO2↑+H2O | ||||
C、碳酸氢铵与足量NaOH溶液混合后加热:NH4++OH-
| ||||
D、铜片与浓硫酸共热:Cu+4H++SO42-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5:108 |
| B、16:207 |
| C、8:1 |
| D、108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、只有①③ |
| C、只有②③ | D、只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||||
| W | Y | Z |
| A、元素Z位于元素周期表的第3周期ⅦA族 |
| B、原子半径的大小顺序为:rY>rW>rX |
| C、元素W的最高价氧化物对应水化物的酸性比Y的强 |
| D、元素X的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
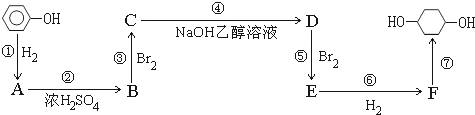
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com