
【题目】化学兴趣小组利用下图装置进行铁与水的反应的实验,并利用产物制取 FeCl36H2O 晶体。(图中的部 分装置略去)
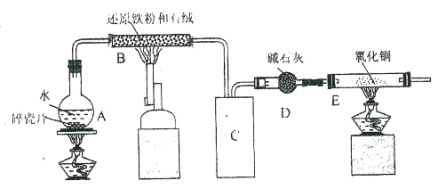
(1)A 中的碎瓷片的作用是_____,B 中发生反应的化学方程式为__________________。
(2)E 装置中的现象是_____。
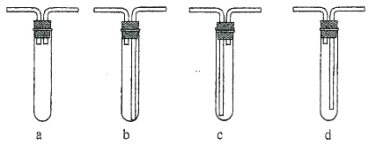
(3)C 装置应该是下列的(________)
(4)反应一段时间后,冷却并取出 B 中的固体,与过量的稀盐酸充分反应后(________)
(a)一定存在![]() (b)一定存在
(b)一定存在 ![]()
(c)可能存在![]() (d)
(d) ![]() 或
或![]() 只存在一种。
只存在一种。
(5)检验其中无![]() 的方法是_____。
的方法是_____。
(6)将上述溶液过滤:滤液![]() 溶液
溶液 ![]() 氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
氯化铁晶体。步骤(I)通入 Cl2 的作用是_____,步骤(II)从较稀的溶液中得到晶体的主要操作包括_____,在此过程中保持盐酸稍过量的原因是_____。
【答案】防止暴沸 ![]() 黑色粉末逐渐变红,管口有水珠生成 c bc 取样,向其中加入 KSCN 溶液,溶液不变红则无
黑色粉末逐渐变红,管口有水珠生成 c bc 取样,向其中加入 KSCN 溶液,溶液不变红则无 ![]() 将
将![]() 氧化成
氧化成![]() 蒸发浓缩、冷却结晶、过滤 抑制
蒸发浓缩、冷却结晶、过滤 抑制![]() 水解
水解
【解析】
⑴A主要是提供B中反应的水蒸气,加热液体水时要注意防暴沸,因此要加碎瓷片,故答案为防止暴沸;
B中是水蒸气和铁在高温条件下反应,发生反应的化学方程式为3Fe +4H2O(g)![]() Fe3O4+4H2,故答案为3Fe +4H2O(g)
Fe3O4+4H2,故答案为3Fe +4H2O(g)![]() Fe3O4+4H2;石棉绒的作用是增大接触面积,是反应更充分;
Fe3O4+4H2;石棉绒的作用是增大接触面积,是反应更充分;
⑵B装置生成氢气,E装置是氢气还原氧化铜的实验,即看到E装置中的现象是黑色粉末逐渐变红,管口有水珠生成;即答案为黑色粉末逐渐变红,管口有水珠生成;
⑶C装置的主要作用是起缓冲、冷却气流,使气体中的水冷凝,开始冷凝的水更好的冷凝后面的水蒸气,且冷凝水不能堵塞产生的氢气导气管,因此c正确,故答案为c;
⑷反应一段时间后,冷却并取出 B 中的固体,B中一定有四氧化三铁可能有没有反应的铁,四氧化三铁与过量的稀盐酸充分反应生成亚铁离子和铁离子,没有反应的铁与铁离子要反应,因此铁离子可能被反应完,也可能没有反应完,而亚铁离子一定有;故bc正确;
⑸检验其中无Fe3+的方法是取少量溶液于试管中,向其中加入KSCN溶液,溶液不变红则无Fe3+,反之则含有Fe3+,故答案取少量溶液于试管中,向其中加入KSCN溶液,溶液不变红则无Fe3+,反之则含有Fe3+;
⑹将上述溶液过滤:滤液![]() 溶液
溶液![]() 氯化铁晶体。步骤(I)通入Cl2的作用是将溶液中的亚铁离子氧化成铁离子,故答案为将Fe2+氧化成Fe3+;
氯化铁晶体。步骤(I)通入Cl2的作用是将溶液中的亚铁离子氧化成铁离子,故答案为将Fe2+氧化成Fe3+;
步骤(II)从较稀的溶液中得到晶体的操作是在氯化氢气流中蒸发浓缩、冷却结晶、过滤洗涤干燥,故答案为蒸发浓缩、冷却结晶、过滤,加入氯化氢或盐酸主要目的是抑制氯化铁水解,故答案为抑制FeCl3水解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
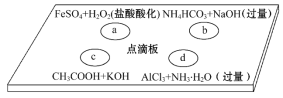
A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向体积为2L的密闭容器中通入NO2 (气体)和N2O4 (无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(1)0~3min内用N2O4表示的平均反应速率为___________。
(2)若升高温度,则v(正)__________(填“加快”“减慢”或“不变”,下同),v(逆)___________。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中v(NO2)=0.2mol·L-1·s-1,乙中v(N2O4)=9mol·L-1·min-1,则_________(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是(_____)
A v(NO2)=2 v(N2O4)
B 容器内压强不再发生变化
C X的体积分数不再发生变化
D 容器内气体的原子总数不再发生变化
E 相同时间内消耗n mol Y的同时生成2n mol X
F 相同时间内消耗n mol Y的同时消耗2n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中氧原子数目与11.7g Na2O2中氧原子数相等的是( )
A.5.6g COB.4.4g CO2C.8g SO3D.9.8g H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.78gNa2O2与足量水充分反应时电子转移数为NA
B.2L1mol/LNa2SO4溶液中离子总数为3NA
C.25℃,101.3kPa时,11.2LH2中含有的原子数为NA
D.4℃,101.3kPa时,54mlH2O中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铝铁合金,加入到足量氢氧化钠溶液,滤出不溶物洗涤后再用一定量盐酸恰好完全溶解,继续在溶液中加入足量氨水,在空气中静置至红褐色沉淀不再增加为止,将沉淀滤出再灼烧至恒重,得到残留 固体的质量与原合金的质量相同,则:
(1)合金溶于足量氢氧化钠溶液所得溶液中含有的阴离子有______ 、_______ ;
(2)沉淀滤出再灼烧至恒重,得到残留固体的化学式为____________________;
(3)合金中铝的质量分数为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收________体积的氨气可制得上述氨水。(水的密度以1.00g/cm3计)
(2)硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2![]() 8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
①1.00molFeS2完全氧化,需要空气的体积(标准状况)为_______L。
②55L空气和足量FeS2完全反应后,气体体积(同温同压)变为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,发生反应:![]() 。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是
。当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是![]()
![]()
A.混合气体的压强B.混合气体的密度
C.混合气体的平均相对分子质量D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
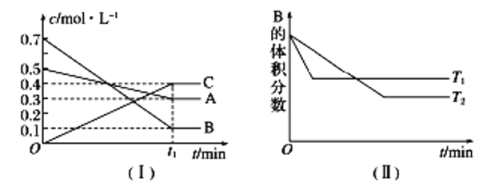
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com