
(11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
Ⅰ. MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
Ⅱ. MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是 。
| A.被氧化的元素是Cu和S |
| B.MnO4-是氧化剂,Cu2S既是氧化剂又是还原剂 |
| C.氧化剂与还原剂的物质的量之比为8∶5 |
| D.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol |
科目:高中化学 来源: 题型:阅读理解
 游泳池中的水经常要消毒杀菌.某化学兴趣小组对游泳池中使用的消毒剂进行了研究性学习.
游泳池中的水经常要消毒杀菌.某化学兴趣小组对游泳池中使用的消毒剂进行了研究性学习.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
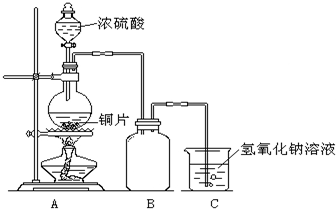 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
| ||
| ||
| m |
| 64 |
| m |
| 64 |
| m |
| 32 |
| m |
| 32 |
| V |
| 22.4×0.012 |
| V |
| 22.4×0.012 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高三9月月考化学化学试卷(解析版) 题型:填空题
(11分)Ⅰ、(1)高锰酸钾是一种典型的强氧化剂。
(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
Ⅰ. MnO4- + Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
Ⅱ. MnO4- + CuS + H+ → Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
请回答下列问题:
①下列关于反应Ⅰ的说法不正确的是 。
A.被氧化的元素是Cu和S
B. MnO4-是氧化剂,Cu2S既是氧化剂又是还原剂
C.氧化剂与还原剂的物质的量之比为8∶5
D.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol
E.氧化性的强弱关系是: MnO4-> Mn2+> Cu2+
②用单线桥表示反应Ⅱ中电子转移的数目和方向: MnO4- + CuS
(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应:
氧化反应: H2O2 - 2e-==2H++O2↑
还原反应: MnO4-+5e-+ 8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式: 。
反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的氧化性强弱的结论是 。
②实验中发现,当加入的少量KMnO4完全反应后,H2O2仍能发生反应放出气体。其可能的原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com