
| A. | 溴苯 乙酸 | B. | 硝基苯 氯乙烷 | C. | 甲苯 乙酸乙酯 | D. | 苯 乙醇 |
科目:高中化学 来源: 题型:选择题
| A. | P、S、Cl原子半径依次减小 | |
| B. | Li、Na、K、Rb的金属性依次增强 | |
| C. | N、O、F最高正价依次升高 | |
| D. | Li、Be、B原子最外层电子数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
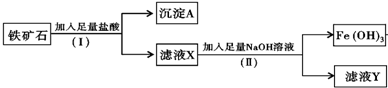
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 | |
| B. | 油脂的提纯中,可将油脂加入浓NaOH 溶液加热,然后过滤,从滤液中可得较纯的油脂 | |
| C. | 将铜丝在酒精灯上加热到红热后,立即伸入无水乙醇中,反复操作多次,可制得乙醛 | |
| D. | 淀粉用酸催化水解后的溶液加入银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com