
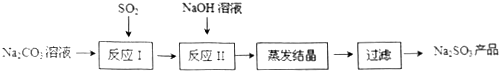
分析 碳酸钠溶液中通入二氧化硫依次发生的反应为Ⅰ:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+CO2,SO2+Na2SO3=2NaHSO3,反应Ⅱ是加入氢氧化钠溶液发生反应:NaHSO3+NaOH=Na2SO3+H2O(主要),SO2+2NaOH=Na2SO3+H2O(次要),得到亚硫酸钠溶液蒸发浓缩、冷却结晶过滤洗涤得到Na2SO3.
(1)二氧化硫与水反应生成亚硫酸,又被氧化为硫酸;
(2)Na2CO3溶液呈碱性;
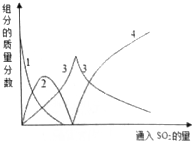
(3)依据反应过程和图象曲线变化可知,图象3表示的是亚硫酸钠,图象2表示的是碳酸氢钠;
(4)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠;
(5)Na2SO3被空气氧化成Na2SO4.
解答 解:(1)二氧化硫与水反应生成亚硫酸,又被氧化为硫酸,则SO2形成硫酸型酸雨,故答案为:酸雨;
(2)亚硫酸的酸性比碳酸强,故用Na2CO3溶液能吸收SO2,故答案为:亚硫酸的酸性比碳酸强;
(3)依据反应过程和图象曲线变化可知,图象3表示的是亚硫酸钠,线2表示的组分为NaHCO3,故答案为:NaHCO3;
(4)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠,反应的化学方程式为:NaHSO3+NaOH=Na2SO3+H2O(主要)、SO2+2NaOH=Na2SO3+H2O(次要),
故答案为:NaHSO3+NaOH=Na2SO3+H2O(主要)、SO2+2NaOH=Na2SO3+H2O(次要);
(5)Na2SO3产品久置后质量变重,主要原因是Na2SO3被空气中氧气氧化成Na2SO4,
故答案为:Na2SO3被空气中氧气氧化成Na2SO4.
点评 本题考查了无机物制备流程、反应原理及其物质组成的实验测定,题目难度中等.


科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| N2 | NO2 | NO | HNO3 |
B | Na | Na2O2 | NaOH | NaCl | |
C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
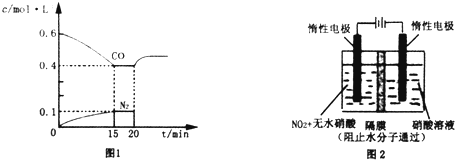
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$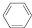 (g)+3H2(g).
(g)+3H2(g).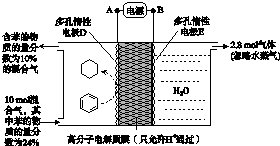
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.| 物质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒精(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
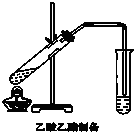
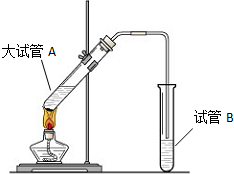 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com