
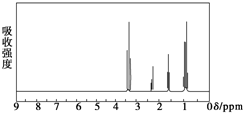
 核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如图所示.则可能是下列物质中的( )
核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如图所示.则可能是下列物质中的( )| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | 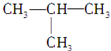 | D. | CH3CH2CHO |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
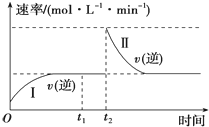 在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )
在一恒温恒压的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0,t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示.下列说法不正确的是( )| A. | 0~t2时,v(正)>v(逆) | |
| B. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ=Ⅱ | |
| C. | t2时刻改变的条件是向密闭容器中加C | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数K(Ⅰ)=K(Ⅱ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
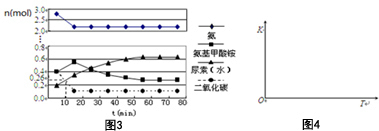
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
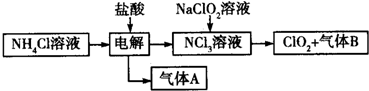
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
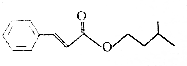
| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能与新制的Cu(OH)2共热生成红色沉淀 | |
| C. | 能与FeCl3溶液反应显紫色 | |
| D. | 能与热的浓硝酸和浓硫酸混合液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com