
(12分)A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题:
(1)物质C、E分别为 、 。(填名称)
(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为 。
(3)反应②的离子方程式为 。
(4)新配制的F溶液应加入________以防止其转化为G。请设计实验检验F、G的混合溶液中F的金属阳离子。(写出试剂、操作、现象、结论) 。
(1)浓盐酸(2分);四氧化三铁(2分)(2)2H2O2 2H2O+O2↑ (2分)
2H2O+O2↑ (2分)
(3)MnO2+4H++2Cl-  Mn2++Cl2↑+2H2O(2分)
Mn2++Cl2↑+2H2O(2分)
(4)铁屑;(2分)取混合溶液少许,加入KMnO4溶液,若溶液紫色褪去,说明有Fe2+存在。(2分)
【解析】
试题分析:根据物质的转化及题意可得:A是H2O2;B是O2;C是HCl;D是Cl2;E是Fe3O4;F是FeCl2;G是FeCl3。(1)物质C名称是浓盐酸, E名称是四氧化三铁;(2)反应①可选用不同的A进行,若反应在常温下进行,其化学方程式为2H2O2 2H2O+O2↑;(3)反应②的离子方程式为MnO2+4H++2Cl-
2H2O+O2↑;(3)反应②的离子方程式为MnO2+4H++2Cl-  Mn2++Cl2↑+2H2O;(4)由于Fe2+容易被空气中的氧气氧化为Fe3+,所以为了防止Fe2+的氧化,在新配制的F溶液应加入还原剂铁粉Fe。检验F、G的混合溶液中F的金属阳离子的实验方法是取混合溶液少许,加入KMnO4溶液,若溶液紫色褪去,说明有Fe2+存在。
Mn2++Cl2↑+2H2O;(4)由于Fe2+容易被空气中的氧气氧化为Fe3+,所以为了防止Fe2+的氧化,在新配制的F溶液应加入还原剂铁粉Fe。检验F、G的混合溶液中F的金属阳离子的实验方法是取混合溶液少许,加入KMnO4溶液,若溶液紫色褪去,说明有Fe2+存在。
考点:考查元素及化合物的推断、化学方程式和离子方程式的书写、物质的性质及Fe2+的检验方法的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
设 NA 为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA
B.物质的量浓度为0.1mol·L-1的MgCl2溶液中,含有Cl-个数为0.2NA
C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D.常温下,22g CO2和N2O混合气体中,含有的原子数目为1.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:填空题
(16分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
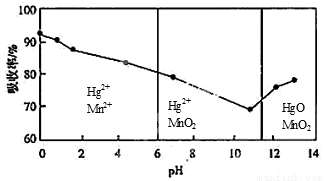
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
下列有关计算的分析不正确的是
A.在反应3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O中,当有1mol铜被氧化时,被还原的硝酸为2/3mol
B.将amolFeS放入含3amolH2SO4的浓硫酸中,充分反应后,氧化、还原产物分别是Fe3+、S和SO2,则放出的SO2气体少于1.5a mol
C.室温时,在容积为aml的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入bmlO2,则管内液面又继续上升,测得试管内最后剩余气体为cml,且该气体不能支持燃烧。则a、b、c的关系为a=4b+3c
D.某溶液100ml,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三上学期第四次检测化学试卷(解析版) 题型:选择题
下列反应的方程式正确的是
A.H2S水溶液呈酸性:H2S= H++HS-
B.醋酸钠溶液和硫酸氢钠混合:CH3COO-+H+=CH3COOH
C.向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
D.碳酸钠溶液呈碱性:CO32-+2H2O=H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
现有如下各种说法:①在水中氢、氧原子间均以化学键相结合 ②硅晶体熔化需要克服分子间作用力 ③离子键是阳离子和阴离子的相互吸引力 ④根据电离方程式HCl===H++Cl-,判断HCl分子里存在离子键⑤有化学键断裂的变化属于化学变化。上述各种说法正确的是
A.都不正确 B.①②⑤ C.②④⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三上学期第二次月考化学试卷(解析版) 题型:选择题
滴加新制氯水后,下列各组离子还可能大量存在的是
A.Fe3+、Al3+、Cl-、NO3- B.K+、Na+、I-、SO42-
C.Ag+、Ca2+、NH4+、NO3- D.Na+、Ba2+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省英文学校高一上学期12月月考化学试卷(解析版) 题型:选择题
决定金属性强弱的是
A.1个金属原子失去电子的多少
B.1 mol金属与酸反应放出氢气的多少
C.1 mol金属失去电子的多少
D.金属原子失去电子的难易程度
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高一上学期第三次考试化学试卷(解析版) 题型:选择题
某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
分析表中数据,下列说法中不正确的是

A.由①、②可知:①中的盐酸过量
B.由②、③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经反应完全
C.所用盐酸的物质的量浓度为0.4 mol·L-1
D.该混合物中NaHCO3的物质的量分数为50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com