
| A. | Zn与稀硫酸反应制取H2时,加入少量硫酸铜 | |
| B. | Al和稀硫酸反应制取H2时,将稀硫酸换成浓硫酸 | |
| C. | 石灰石与稀盐酸反应生成CO2时,将石灰石粉碎 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
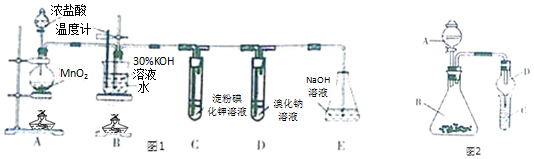
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
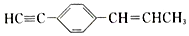 的说法中不正确的是( )
的说法中不正确的是( )| A. | 最多只有5个碳原子在同一直线上 | B. | 最多有11个碳原子在同一平面上 | ||
| C. | 有7个碳原子可能在同一直线上 | D. | 最多有19个原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
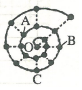 小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
小明在研究元素时发现,可以将前18号元素排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 | |
| B. | 离O点越远的元素原子半径一定越大 | |
| C. | B、C最高价氧化物的水化物可以相互反应 | |
| D. | B元素是图中金属性最强的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com