
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W,����X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ�����;Y����Ԫ�ؿ����Y2O��Y2O2�����ӻ����
(1)Y2O2���еĻ�ѧ���зǼ��Թ��ۼ���_____,�û���������______������ӻ���� �������ۻ��������
(2)�õ���ʽ��ʾY2O���γɹ���______________________________��
(3)Z��W����Ԫ�ص�����������Ӧ��ˮ������,������ǿ��ˮ������_____(�ѧʽ)��
(4)X������ɵĻ�������, �Ⱥ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ��Ļ�����Ľṹʽ__________��
(5)��X��W��ɵĻ����������,X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ,�û�������ˮ���������ֻ��������һ�־���Ư����,��һ����ʹʪ��ĺ�ɫʯ����ֽ������д���û�������ˮ��Ӧ�Ļ�ѧ����ʽ_________________��
���𰸡� ���Ӽ� ���ӻ����� ![]() HClO4
HClO4 ![]() NCl3+3H2O
NCl3+3H2O![]() 3HClO+NH3
3HClO+NH3
��������ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W��Y����Ԫ�ؿ����Y2O��Y2O2���ӻ������YΪ��Ԫ�أ�X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ����Xԭ��������С���ƣ�����XΪ��Ԫ�أ�Z��Wԭ�������������ƣ�ZΪ��Ԫ�أ�WΪ��Ԫ�أ�
(1)�������Ƶĵ���ʽΪ![]() �����к��еĻ�ѧ��Ϊ���Ӽ������ۼ��������ӻ����
�����к��еĻ�ѧ��Ϊ���Ӽ������ۼ��������ӻ����
(2)Na2O�����ӻ���������ʽ�γɹ���Ϊ![]() ��
��
(3)��Ԫ�طǽ����Ա���Ԫ��ǿ��������Ԫ�ص�����������Ӧ��ˮ������,������ǿ��ˮ������HClO4��
(4)N��H�γɵļȺ��м��Թ��ۼ��ֺ��зǼ��Թ��ۼ��Ļ�����ΪN2H4����ṹʽΪ![]() ��
��
(5)��X��W��ɵĻ���������У�X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ����û�����ΪNCl3����ˮ������һ�־���Ư���ԵĻ�����Ϊ�������һ�ִ̼�����ζ��������Ϊ��������Ӧ�Ļ�ѧ����ʽΪNCl3+3H2O�T3HClO+NH3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ά����A�ķ��ӽṹ:
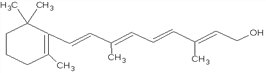
��1��ά����A�ķ���ʽ��__________________��1molά����A�������____________mol�巢���ӳɷ�Ӧ��
��2������Ҫ��д�������л���Ľṹ��ʽ����ϵͳ������
CH3CH��CH3��C��CH3��2CH2CH3 :__________________________________��
2������2����ϩ:________________________________________________��
�����ǶԱ�������������ʶ��һ��������Ĺ��̡�
��3����֪����ʽΪC6H6�Ľṹ�ж��֣����е����ּ�ͼ(��)��(��):
![]()
�������ֽṹ����������ڣ�
���Է���(����ѧ���ʷ���)������_______(����ĸ����ͬ)������________��
A�������Ը��������Һ���� B����������Ȼ�̼��Һ�����ӳɷ�Ӧ
C�������ڴ��������·���ȡ����Ӧ D�������������ӳɷ�Ӧ
�������棺1molC6H6��H2�ӳ�ʱ������________mol��������_______mol��
�ڽ���C6H6������һ����ͼ����ṹ![]() ���ýṹ�Ķ��ȴ�����________�֣�
���ýṹ�Ķ��ȴ�����________�֣�
�۸��ݱ��ķ��ӽṹ�������Ʋⱽ�����ʱȽ��ȶ���������ȡ����Ӧ���������ӳɺ�������Ӧ��д�����������ڴ��������·�Ӧ�Ļ�ѧ����ʽ____________________________
��4����֪���Ľṹ��ʽΪ ![]() �����й�������˵����ȷ����_______(����)
�����й�������˵����ȷ����_______(����)
A�����ķ���ʽΪC10H10 B��1mol������6molH2�����ӳɷ�Ӧ
C��������������ԭ����ͬһƽ���� D��һ�����ֻ������ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±����и��������У�����֮��ͨ��һ����Ӧ����ʵ������ͼ��ʾת������
ѡ�� | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�����ʵ���Ʊ�������������ͼ1����
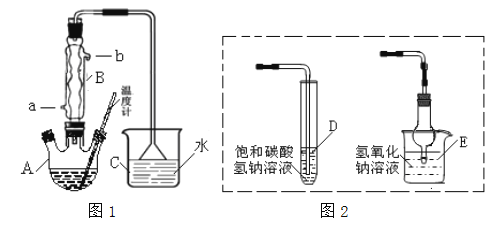
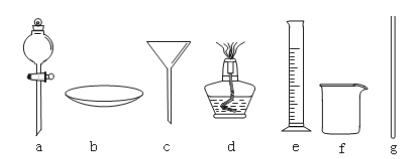
(1)ʵ��ʱ������A�мӼ�����ʯƬ����������________�� ����BΪ�����ܣ���ȴˮ�� ________ ���a����b��������
(2)ͼ1����������ȱ�ݣ�������Ľ�����______________________________���������������IJ�����Ҫ��ͼ3������________������ţ���
(3)���ܷ���ͼ2��Dװ�����ͼ1��װ��C___����ܻ��
���ܷ���ͼ2��Eװ�����ͼ1��Cװ��________ ����ܻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤������ֵ��������������ȷ����
A. ���ۿ�������� B. 13g���к�C-H������Ŀ��NA
C. C4H10O�Ĵ���5�� D. ��״���£�11.2L�������ϩ�Ļ���ﺬ��ԭ������2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2O2��˵���У�����ȷ����
A. ��dz��ɫ���� B. ������������
C. ��H2O��Ӧʱ��H2O����ԭ�� D. ��H2O��Ӧʱ���ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���з�ӦN2(g)��3H2(g) ![]() 2NH3(g) ��H<0��
2NH3(g) ��H<0��
��1���ں��º�ѹ�����½��У���Ӧ������е���________����Ӧ������е���________������ƽ��״̬����________�����ж��Ƿ�ﵽƽ�����________��
A����λʱ��������1mol N2��ͬʱ����3mol NH3
B����λʱ��������3mol N2��ͬʱ����6mol N��H��
C�����������ܶȲ�����ʱ����ı�
D�������������ѹǿ������ʱ����ı�
��2����һ���¶���ij�����ܱ������У�����3molH2��1mol��N2��2min�ﵽƽ��״̬ʱ���ܵ���������ʵ�����Ϊԭ����9/10�����ʱN2��ת����Ϊ__________��
����ʱ�ų�������Ϊ18.44 kJ�������Ȼ�ѧ����ʽΪ______________________________ .
������������Ȼ�ѧ����ʽ������֪1mol��������������ҪΪ945.8kJ��������1mol�����������Ҫ436 kJ����������1molN-H���������յ�����_____��
��3����������������ȼ�ϵ�ص�ȼ�ϣ���ط�ӦΪ4NH3+3O2�T2N2+6H2O��
��ȼ�ϵ�صĸ����缫��ӦΪ________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ܴﵽʵ��Ŀ���ǣ�������
A.����ˮ���ռ�ͭ����Ũ���ᷴӦ������NO2
B.�ð�ˮ����NaCl��MgCl2��AlCl3��NH4Cl������Һ
C.������KMnO4��Һ��֤����Ļ�ԭ��
D.�ñ���NaHCO3��Һ��ȥCl2�л��е�HCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com