
| A. | 10种 | B. | 12种 | C. | 15种 | D. | 18种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | H、D、T表示同一种核素 | B. | F-原子结构示意图: | ||
| C. | 用电子式表示HCl形成过程 | D. | NaOH既含共价键又含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 我国许多城市已经推广使用清洁燃料以减少环境污染,如压缩天然气(CNG)、液化石油气(LPG),这两类燃料的主要成分均是烃类 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 当今,实现煤的综合利用的主要途径是通过煤的干馏、煤气化和煤液化而获得洁净的燃料和多种化工原料 | |
| D. | 工业上利用金属活泼性不同,采用不同的冶炼方法冶炼金属,如电解法冶炼铝、热还原法冶炼铁、热分解法冶炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 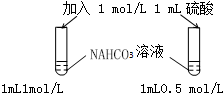 探究浓度对化学反应速率的影响 | B. | 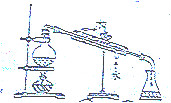 分离乙醇和乙酸的混合溶液 | ||
| C. | 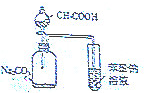 证明酸性:CH3COOH>H2CO3>苯酚 | D. | 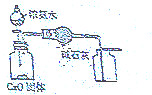 制取并且收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是银白色、质软的金属 | |
| B. | 阳离子氧化性比铝离子强 | |
| C. | 加热蒸干TiCl3溶液可得到无水TiCl3 | |
| D. | 与稀硝酸作用生成硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
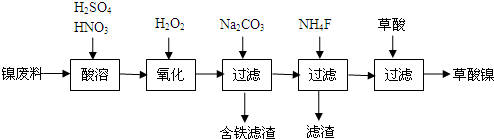
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com