
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HF比HCl稳定是因为HF间存在氢键 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
分析 A、二氧化碳是分子晶体;二氧化硅是原子晶体;
B、硅是原子晶体,而硫是分子晶体;
C、稳定性是化学性质;
D、NaOH是含共价键的离子化合物、NH4Cl是含共价键的离子化合物.
解答 解:A、二氧化碳是分子晶体;二氧化硅是原子晶体,所以两者的晶体结构类型不同,故A正确;
B、硅是原子晶体,而硫是分子晶体,两晶体熔化,克服的作用力分别是共价键和分子间作用力,故B正确;
C、稳定性是化学性质,因为非金属性F强于Cl,所以HF比HCl稳定,与氢键无关,故C错误;
D、NaOH是含共价键的离子化合物、NH4Cl是含共价键的离子化合物,所以NaOH、NH4Cl晶体中既有离子键又有共价键,故D正确;
故选C.
点评 本题考查了晶体类型的判断等知识点,根据晶体的构成微粒确定晶体类型,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与过量KOH浓溶液:NH4++OH-═NH3↑+H2O | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,100 mL 1 mol•L-1 Na2CO3溶液中含有的阴离子数大于0.1NA | |
| B. | 常温常压下,28g14CO和N2的混合物所含的质子数为14NA | |
| C. | 将NA个NH3分子溶于1L水中得到1 mol•L-1的氨水 | |
| D. | 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | |
| B. | 热的纯碱溶液可用于除去物品表面的油污 | |
| C. | 铵态氮肥和草木灰(主要成分碳酸钾)不能混合使用 | |
| D. | 配制FeCl2溶液时需要向溶液中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气是氧化产物 | |
| B. | O2F2是氧化剂 | |
| C. | 若生成 4.48 L HF,则转移 0.8 mol 电子 | |
| D. | 还原剂与氧化剂的物质的量之比为 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸有酸性,可用于漂白、杀菌消毒 | |
| B. | 纯碱能与酸反应,可用作治疗胃酸过多的药物 | |
| C. | 液氨汽化时要吸收大量的热,工业上可用作制冷剂 | |
| D. | 晶体硅的熔点高、硬度大,可用于制作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
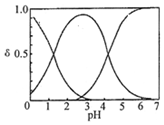 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A. | 0.1mol•L-1H2C2O4溶液使KMnO4溶液褪色的离子方程式:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铁片与电源正极相连、碳棒与电源负极相连放入食盐水中,证明铁被保护 | |
| B. | 电解AlCl3溶液制取铝单质 | |
| C. | 用25 mL滴定管量出14.80 mL溶液 | |
| D. | 用pH试纸测得某碱溶液的pH为12.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com