
下列有关溶液的叙述中,正确的是
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下: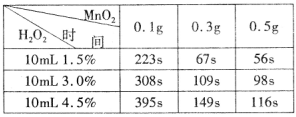
分析表中数据回答下列问题,
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而____________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入_____g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确_______理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
| A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3) |
| B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-) |
| C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-) |
| D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的 原子数必为 原子数必为 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
己知25℃时,Ksp(AgCl) =1.8×10-10,Ksp(AgBr) =5.4×10-13,Ksp(AgI) =8.5×10-17。某溶液中含有C1-、Br-和I-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.C1-、Br-、I- | B.Br-、C1-、I- |
| C.I-、Br-、C1- | D.Br-、I-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com