
【题目】石油是工业的血液,与我们的生产、生活息息相关,乙烯的产量通常用来衡量一个国家的石油化工水平。根据下面转化关系回答下列问题:
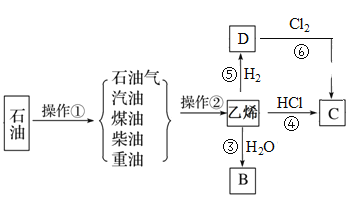
(1)操作①、操作②的名称分别为_____、_____。
(2)乙烯的结构简式为_______。
(3)写出乙烯和水反应生成B的反应③的方程式(注明条件):_____,反应类型为_____。
写出反应⑥的化学方程式(注明条件):_________。
(4)物质C的沸点为12.27 ℃,常用于局部冷冻麻醉应急处理。物质C可通过反应④和反应⑥制得,其中最好的方法是反应____(填“④”或“⑥”),理由为_____。
【答案】石油的分馏 石油的裂解 CH2=CH2 CH2=CH2+H2O![]() CH3CH2OH 加成反应 CH3CH3+Cl2
CH3CH2OH 加成反应 CH3CH3+Cl2![]() CH3CH2Cl+HCl ④ 乙烷与氯气反应将得到多种氯代物的混合物,产物不纯
CH3CH2Cl+HCl ④ 乙烷与氯气反应将得到多种氯代物的混合物,产物不纯
【解析】
石油经过分馏可生产液化石油气、汽油、煤油、柴油等产品,而上述产品再经过高温裂解可得到乙烯等化工产品,乙烯与水发生加成反应生成乙醇(B),乙烯与氯化氢发生加成反应生成氯乙烷(C),乙烯与氢气发生加成反应生成乙烷(D),加成答题。
(1)石油经过分馏可生产液化石油气、汽油、煤油、柴油等产品,而上述产品再经过高温裂解可得到乙烯等化工产品,所以操作①、操作②的名称分别为石油的分馏、石油的裂解,故答案为:石油的分馏,石油的裂解。
(2)乙烯为平面四边形结构,官能团为碳碳双键,结构简式为CH2=CH2,故答案为:CH2=CH2。
(3)乙烯和水发生反应生成乙醇,化学方程式为:CH2=CH2+H2O![]() CH3CH2OH,该反应为加成反应,反应⑥为乙烷与氯气在光照条件下发生取代反应生成氯乙烷,反应方程式为:CH3CH3+Cl2
CH3CH2OH,该反应为加成反应,反应⑥为乙烷与氯气在光照条件下发生取代反应生成氯乙烷,反应方程式为:CH3CH3+Cl2![]() CH3CH2Cl+HCl,故答案为:CH2=CH2+H2O
CH3CH2Cl+HCl,故答案为:CH2=CH2+H2O![]() CH3CH2OH,加成反应,CH3CH3+Cl2
CH3CH2OH,加成反应,CH3CH3+Cl2![]() CH3CH2Cl+HCl。
CH3CH2Cl+HCl。
(4)氯乙烷可通过乙烯与氯气发生加成反应和乙烷与氯气发生取代反应制得,最好的方法是加成反应(④),因为乙烷与氯气反应将得到多种氯代物的混合物,产物不纯,故答案为:④;乙烷与氯气反应将得到多种氯代物的混合物,产物不纯。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】已知几种元素的性质或原子结构的相关叙述如表所示。
元素 | 元素性质或原子结构的相关叙述 |
T | 失去1个电子后,形成与Ne相同的核外电子排布 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
回答下列问题:
(1)写出工业上用X的单质来制备粗硅的化学方程式_________________________。
(2)Y形成的另一种单质主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是________。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是__________(写化学式)。
(4)画出T原子的结构示意图:____________。
(5)T元素组成的单质在Y元素组成的常见单质中燃烧,得到的产物的化学式是________,电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面上,H的分子式是C7H8。
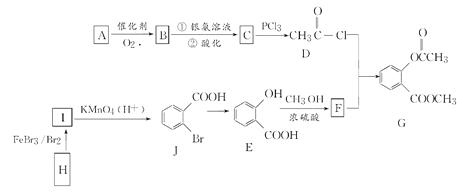
已知:![]()
请回答以下问题:
(1)A的结构简式是________。
(2)H→I的化学反应方程式为________,B与银氨溶液反应的化学方程式是_______________________________。
(3)C→D的反应类型是________,I→J的反应类型是________。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是________________________________________________________________________。
(5)满足以下条件的F的同分异构体(含F)共有________(填数字)种。
①能与氯化铁溶液发生显色反应
②红外光谱等方法检测分子中有-COO-结构 ③苯环上有两个取代基
其中能与碳酸氢钠溶液反应且核磁共振氢谱测定有5个吸收峰的同分异构体的结构简式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
(1)判断该反应达到平衡的标志是______。
a.容器中的压强保持不变 b.A的生成速率与B的消耗速率之比为2:1
c.容器内混合气体的密度保持不变 d.A的百分含量保持不变
e.B和C的物质的量浓度之比为1:x
(2)x=___, 从反应开始到达到平衡时,用B表示该反应的平均反应速率v(B)=____;
(3)化学反应达到平衡时,A的转化率为_____。
(4)某化学兴趣小组同学为了研究上述反应的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线。
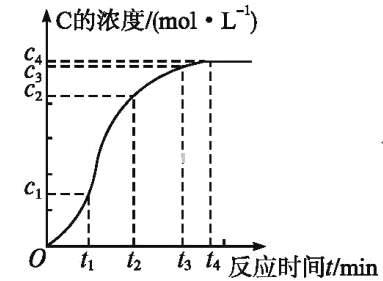
在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的时间段是____,从反应速率的变化可看出该反应可能是____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.7 g铝放入足量氢氧化钠溶液中完全反应后,在标准状况下,生成气体的体积是( )
A.1.12 LB.2.24 LC.3.36 LD.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl- 与SO42-的物质的量之比为

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:
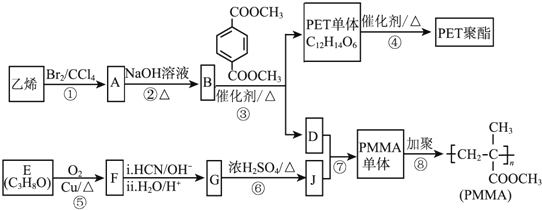
已知:

(1)PMMA单体的官能团名称是________
(2)②的化学方程式为_______________________________________
(3)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为___________________________
(4)G的结构简式为________________________________
(5)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是______________
(6)写出由PET单体制备PET聚酯并生成B的化学方程式:________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com