
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
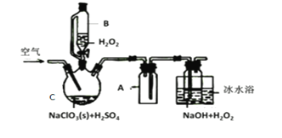
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
【答案】降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解 空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解率降低 2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O 当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复 90.5%
【解析】
氯酸钠在酸性条件下与过氧化氢生成二氧化氯,二氧化氯与氢氧化钠容易和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随着温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,据此分析(1)-(3)问。(4)根据碘遇淀粉变蓝色,Na2S2O3标准液消耗碘单质,根据颜色变化说明滴定终点;根据电子转移数守恒结合关系式NaClO2~2I2~4S2O32-进行求解。
(1)冰水浴冷却的目的是降低NaClO2的溶解度,低温可以减少H2O2的分解;ClO2熔点-59℃、沸点11℃,所以低温可以增加ClO2的溶解度,减少ClO2的分解,故答案为:降低NaClO2的溶解度、减少H2O2的分解、增加ClO2的溶解度、减少ClO2的分解;
(2)空气流速过慢时,ClO2不能及时被移走,浓度过高ClO2易分解,最终导致NaClO2产率降低,故答案为:空气流速过慢时,ClO2不能及时被移走,浓度过高ClO2易分解,最终导致NaClO2产率降低;
(3)氯离子存在是会催化二氧化氯的生成,反应开始时在三颈烧瓶中加入少量盐酸,二氧化氯的生成速率大大提高,并产生微量的氯气,方程式为2ClO3-+2Cl-+4H+=2C1O2↑+Cl2↑+2H2O;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,因此当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复,说明到达滴定终点;因溶液中n(S2O32-)=2molL-1×0.02L×![]() =0.4mol,令样品中NaClO2的质量分数为x,则:
=0.4mol,令样品中NaClO2的质量分数为x,则:
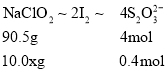
所以90.5g:10.0 xg=4mol:0.4mol,解得x=90.5%,故答案为:当最后一滴滴定液滴下后,溶液由蓝色变无色,且30秒内不恢复;90.5%。


科目:高中化学 来源: 题型:
【题目】反应![]() 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持容器体积不变,增加H2O(g)的量
B.保持容器体积不变,充入氦气使体系压强增大
C.将容器的体积缩小一半
D.保持容器压强不变,充入氦气使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
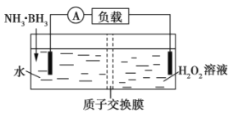
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为![]() ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,D为既能溶于强酸又能溶于强碱的白色胶状物质,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,D为既能溶于强酸又能溶于强碱的白色胶状物质,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出A的化学式:________
(2)写出 B的电子式______________
(3)反应![]() 中每生成
中每生成![]() ,转移电子的数目为________
,转移电子的数目为________![]() 用
用![]() 表示阿伏加德罗常数
表示阿伏加德罗常数![]()
(4)反应![]() 的化学方程式为:______________________________
的化学方程式为:______________________________
(5)写出H不足时反应![]() 的离子方程式_______________________________________
的离子方程式_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
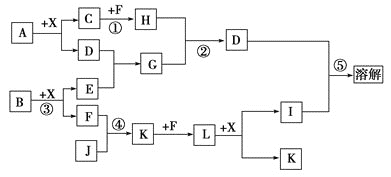
【题目】物质A由三种元素组成。M是单质,空气的主要成分之一。B是一种固体单质,组成该物质的元素在A中的质量分数约为![]() 。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:
。C、D均由两种元素组成,C中两元素同主族。I是一种建筑用的黏合剂。各物质之间的转化关系如图:

请回答:
![]() 中所含元素是_____________
中所含元素是_____________![]() 填元素名称
填元素名称![]() 。
。
![]() 与M反应的化学方程式为_______________________________________。
与M反应的化学方程式为_______________________________________。
![]() 写出
写出![]() 的离子方程式___________________________________________。
的离子方程式___________________________________________。
![]() 请设计实验方案证明E可能的成分___________________________________________。
请设计实验方案证明E可能的成分___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
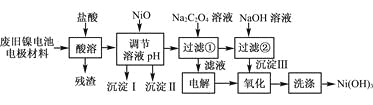
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
|
| 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
(1) 用NiO调节溶液的pH,依次析出沉淀Ⅰ________和沉淀Ⅱ__________(填化学式)。
(2) 写出加入Na2C2O4溶液的反应的化学方程式:_____________________。
(3) 检验电解滤液时阳极产生的气体的方法:___________________________。
(4) 写出“氧化”反应的离子方程式:___________________________________。
(5) 如何检验Ni(OH)3已洗涤干净?_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
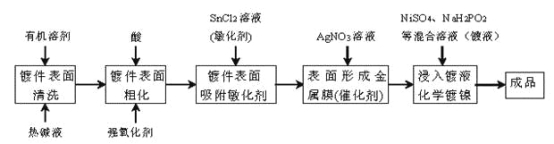
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:

由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3·xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:
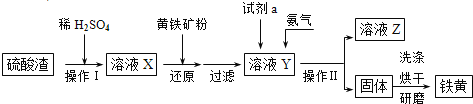
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是___、___。
(2)试剂a最好选用___(供选择使用的有:铝粉、空气、浓HNO3);其作用是___。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是___(填序号)。
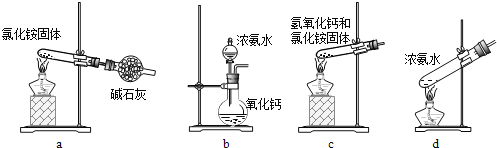
(4)检验溶液Z中含有NH4+的方法是___。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如图所示。
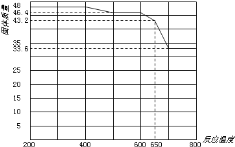
根据图象推断650℃时Fe2O3还原产物的化学式为___,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)。___。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com