

���� �������Ũ���ᷴӦ�IJ���֮һ��TiOSO4��������м���ɷ�ֹFe2+��������������AΪFe����ҺX�к���FeSO4��TiOSO4��������������������������ҺY����ҺY��Ҫ����TiOSO4������ˮ�����ȿ�ˮ������H2TiO3����������BΪH2O�������տ�����TiO2����������̼��Ӧ������TiCl4��������������þ��Ӧ������Ti���Դ˽����⣮
��� �⣺�������Ũ���ᷴӦ�IJ���֮һ��TiOSO4��������м���ɷ�ֹFe2+��������������AΪFe����ҺX�к���FeSO4��TiOSO4��������������������������ҺY����ҺY��Ҫ����TiOSO4������ˮ�����ȿ�ˮ������H2TiO3����������BΪH2O�������տ�����TiO2����������̼��Ӧ������TiCl4��������������þ��Ӧ������Ti��
��1����������ķ�����֪��AΪFe��BΪH2O��TiOSO4�м���ˮ�����ȿ�ˮ������H2TiO3����Ӧ�����ӷ���ʽΪTiO2++2H2O�TTiO��OH��2��+2H+��
�ʴ�Ϊ��Fe��H2O��TiO2++2H2O�TTiO��OH��2��+2H+��
��2������FeSO4•7H2O���ܽ�����߿�֪�������������ܽ�����¶ȵ����߶��������Դ���Һ�з����FeSO4•7H2O������ͨ�����¡��ᾧ�����˵ķ�����ã�
�ʴ�Ϊ�����¡��ᾧ�����ˣ�
��3��������TiO2�Ʊ�����Ti��ԭ����֪������Ũ��������������Ƶ��������Ƶõ����������Ȼ��⡢ˮ�����ʣ�����ͨ������ʳ��ˮ��Ũ�����ȥ�����ڹ�ʽ��¯���������Ȼ��ѣ���Ӧ����δ��Ӧ������������Ⱦ����������β��Ҫ������������Һ���գ�Ϊ��ֹβ������װ���е�ˮ�ֻӷ����ռ����Ȼ��ѵ������У����ռ�װ�ú�β������װ��֮��Ҫ��һ������װ�ã����Ԣ�װ�ð�������������������˳��ΪA��E��B��F��D��C��G���ڸ�������ķ�����֪��B��װŨH2SO4��G��װNaOH��Һ��
�ʴ�Ϊ����E��B��F��D��G����ŨH2SO4��NaOH��Һ��
��4�����ݵ��ӵ�ʧ�غ��֪����TiO2�ܽⲢ��ԭΪTi3+��Ti3+��NH4Fe��SO4��2��Һ��Ӧʱ�й�ϵʽTiO2��Ti3+��NH4Fe��SO4��2������0.20mol•L-1��NH4Fe��SO4��2��Һ36.75mL����NH4Fe��SO4��2�����ʵ���Ϊ36.75��10-3L��0.20mol•L-1=7.35��10-3mol����TiO2�����ʵ���Ϊ=7.35��10-3mol��������Ʒ��TiO2������������$\frac{7.35��1{0}^{-3}��80}{0.60}$��100%=98%��
�ʴ�Ϊ��98%��
���� ���⿼�����ʵ��Ʊ�ʵ�鷽������ƣ�������ѧ���ķ���������ʵ�����������������Ŀ��飬Ϊ�߿��������ͣ��Ѷ��еȣ�ע�����ʵ��Ļ���ԭ�������ʵ����ʣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5�� | B�� | 4�� | C�� | 3�� | D�� | 2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ�͵⻯�ط�Ӧ��Cl2+2I-=2Cl-+I2 | |
| B�� | �������̺�������������MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+Cl2�� | |
| C�� | ������Ư�ۣ�2OH-+Cl2=Cl-+Cl0-+H2O | |
| D�� | ������ˮ��Ӧ��Cl2+H2O=H++Cl-+HClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij����С���ͬѧ���÷�������ȡ���������壬��֪���������������ҺpH��ϵ��ͼ��ʾ��
ij����С���ͬѧ���÷�������ȡ���������壬��֪���������������ҺpH��ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6.4g��O3��O2��ɵĻ��������һ������0.4NA��ԭ�� | |
| B�� | ���³�ѹ�£�5.6g������7.1g�����г��ȼ�գ�ʧȥ�ĵ�����ĿΪ0.3NA | |
| C�� | �����£�pH=1��HNO3��Һ�к���0.1NA��H+ | |
| D�� | 0.1mol KHSO4����������������0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��CO������Ϊ���к���������HCl��
��CO������Ϊ���к���������HCl���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
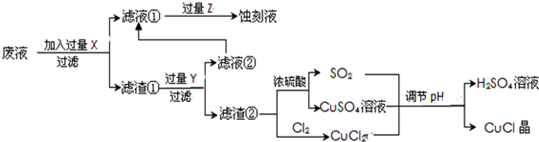
| 1 | 2 | 3 | |
| �հ�ʵ���������������Һ�������ml�� | 0.75 | 0.50 | 0.80 |
| 0.25����Ʒ�������������Һ�������ml�� | 24.65 | 24.75 | 24.70 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪N2��g��+3H2��g��?2NH3��g����H=-92.4KJ/mol���ڸ÷�Ӧ�У�����3NA����ת��ʱ�������Ȼ�ѧ��Ӧ����ʽ���ʱ�Ϊ��H=-46.2KJ/mol | |
| B�� | 1L 0.1mol•L-1̼������Һ����������������0.1NA | |
| C�� | ������pH=13��NaOH��Һ�к��е�OH-0.1NA | |
| D�� | Ũ�ȷֱ�Ϊ1mol•L-1��0.5mol•L-1��CH3COOH��CH3COONa���Һ��1L����CH3COOH��CH3COO-��1.5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com