
| A. | 硼 | B. | 锂 | C. | 氢 | D. | 镁 |
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
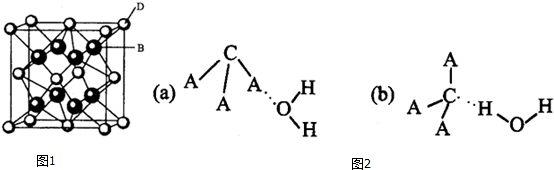
 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用福尔马林保存生物标本 | |
| B. | 试管上沾有苯酚时,用水洗 | |
| C. | 实验室不慎将Hg洒在地上时,立即用硫粉覆盖 | |
| D. | 皮肤上沾有苯酚时,立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
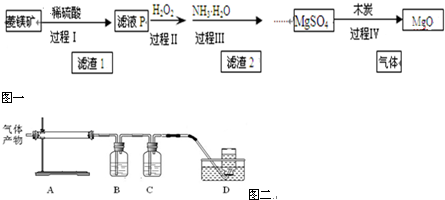
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
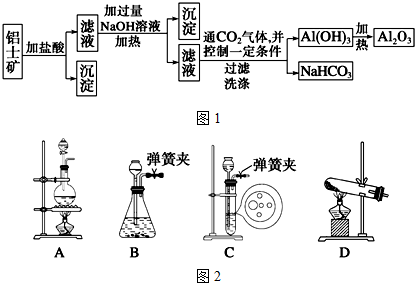
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com