
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
分析 A.溶液的pH=7,则c(H+)=c(OH-),根据混合液中的电荷守恒判断;
B.根据混合液中的物料守恒判断;
C.设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:$\frac{0.1mol/L×2×1L-0.1mol/L×1L}{2L}$=0.05mol/L;
D.加入氯化铵后,溶液中铵根离子浓度增大,抑制了一水合氨的电离,则氢氧根离子浓度减小,结合氨水的电离平衡常数分析.
解答 解:A.向NaHCO3溶液中通CO2至pH=7,c(H+)=c(OH-),结合电荷守恒可知:c(Na+)=c(HCO3-)+2c(CO32-),故A正确;
B.向CH3COONa溶液中加入等浓度等体积的盐酸,钠离子和氯离子的物质的量相等,则:c(Na+)=c(Cl-),故B正确;
C.向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液,设溶液体积都是1L,反应后溶液中氢氧根离子浓度为:$\frac{0.1mol/L×2×1L-0.1mol/L×1L}{2L}$=0.05mol/L,溶液中氢氧根离子浓度不是0.1mol/L,溶液的pH≠13,故C错误;
D.氨水中加入少量NH4Cl固体,铵根离子浓度增大,抑制了一水合氨的电离,导致溶液中氢氧根离子浓度减小,而$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{K}_{b}}{c(O{H}^{-})}$,所以该比值增大,故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
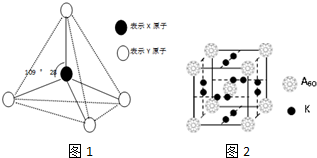
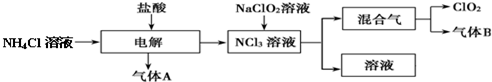
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
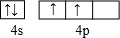
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HBr>HI | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| D. | Mg、Al与同浓度盐酸反应,Mg更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验过程 | 现象 | 解释或结论 |
| A | 向浑浊的苯酚溶液中加入Na2CO3饱和溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| B | 向稀苯酚溶液中加入少量稀溴水 | 未见白色沉淀 | 苯酚不与溴反应 |
| C | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 证明:乙醇具有还原性 |
| D | 将乙醇和3mol•L-1的硫酸按体积之比1:3混合共热至170℃,产生的气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙醇发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
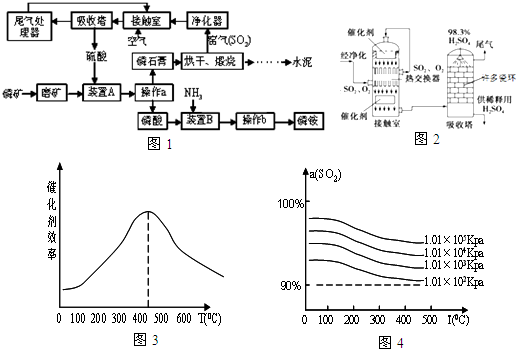
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
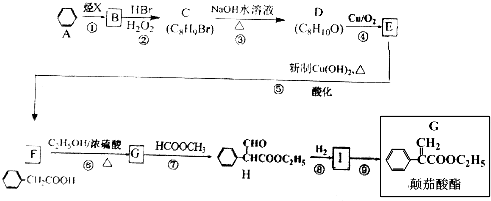
 ;
; $→_{△}^{浓硫酸}$
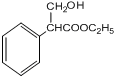
$→_{△}^{浓硫酸}$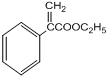 +H2O;
+H2O;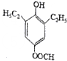 、
、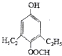
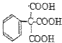 的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com