
| R | X | Y |
| Z | W |
| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | R、X、Y、Z、W各元素最高价和最低价的绝对值之和均为8 | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、W | |
| D. | RY3、W2X、ZW5分子中每个原子最外层都达到8 电子结构 |
分析 R、X、Y、Z、W是短周期主族元素,由图可知,R为第二周期元素,R最高价氧化物对应水化物与其简单气态氢化物反应可以形成离子化合物,离子化合物为硝酸铵,则R为N元素,结合元素在周期表的位置可知,Z为P,X为O,Y为F,W为Cl,以此来解答.
解答 解:由上述分析可知,R为N,Z为P,X为O,Y为F,W为Cl,
A.非金属性越强,对应氢化物越稳定,则最简单气态氢化物的热稳定性由强到弱的排序:Y、X、R、Z,故A错误;
B.O、F无正价,只有R、Z、W各元素最高价和最低价的绝对值之和均为8,故B错误;
C.非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物的水化物酸性由弱到强的排Z、R、W,故C正确;
D.ABn型化合物中A的族序数+n=8时,RY3、W2X分子中每个原子最外层都达到8 电子结构,而ZW5分子中Z原子不满足8电子结构,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物知识来推断元素为解答的关键,R为元素推断的突破口,侧重分析与应用能力的考查,注意规律性知识的应用,选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 分子中有1个手性碳原子 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 1mol杀鼠灵最多能与9molH2反应 | D. | 能萃取碘水中的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=4的氯化铵溶液中:c(H+)=c(NH3•H2O )=1×10-4mol•L-1 | |
| B. | pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<② | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1KHS溶液中:c(K+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| B. | 常温下,0.1 mol/L 的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③ | |
| C. | 在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
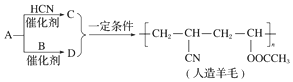
| A. | A生成D的反应属于取代反应 | B. | A生成C的反应属于加成反应 | ||
| C. | 合成人造羊毛的反应属于加聚反应 | D. | 烃A的结构简式为CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时 间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中的4个C-H键完全相等 | B. | CH3Cl 只有1种 | ||
| C. | CH2Cl2不存在同分异构体 | D. | CHCl3不存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )
如图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜.用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀.下列说法正确的是( )| A. | 甲中A处通入CH4,电极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 乙中电解MgCl2溶液的总反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2 | |
| D. | 甲、乙中电解质溶液的pH都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com