
| A、SiO2的键长大于CO2的键长 | B、SiO2是原子晶体而CO2是分子晶体 | C、SiO2的相对分子质量比CO2的大 | D、CO2和SiO2中,碳原子和硅原子的杂化类型相同 |
科目:高中化学 来源: 题型:阅读理解
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)(14分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
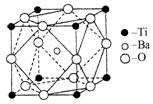
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。
查看答案和解析>>
科目:高中化学 来源:2012届河北省衡水中学高三上学期四调考试化学试卷 题型:填空题
(I)多项选择题
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是 晶体。
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体。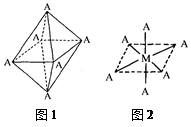
(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取 杂化。
(2)R是1~36
号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+  R(OH)3
R(OH)3  [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为 ;
②[R(OH)4]-中存在的化学键是 。
A.离子键 B.极性键 C.非极性键 D.配位键
查看答案和解析>>
科目:高中化学 来源:2011届海南省海口市高三下学期高考调研测试(二)化学试卷 题型:填空题
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |

 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三3月摸底考试理综化学试卷(解析版) 题型:填空题
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?????? 。
(2)下列说法错误的是??????? 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物???????? (高或低),
原因是?????????? 。
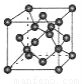
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为??????? cm。

(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为________ __。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)4]2+,该离子的结构式为??????? (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有?????? 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第四次联考理综化学试卷(解析版) 题型:填空题
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序?????? 。
(2)下列说法错误的是??????? 。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H2O>H2S
(3)E元素的+2价氧化物的熔点比+3价氧化物???????? (高或低),原因是?????????? 。
(4)B单质的一种同素异形体的晶胞如图所示,若晶体的密度为ρg/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个原子之间的距离为??????? cm。
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。
①F原子的外围电子排布式为____ 。向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成【F(N)4】2+,该离子的结构式为??????? (用元素符号表示)。
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子:该离子中碳原子的杂化方式有?????? 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com