
【题目】A、B、C、D、E、F、X为周期表前四周期的元素,A→F原子序数依次增大。A位于第一周期,B原子有3个不同的能级,各能级的电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的电子层结构;F元素有“生物金属”之称,F4+离子和氩原子核外电子排布相同;X是第三周期电负性最大的元素。回答下列问题:
(1)F基态原子的核外电子排布式______________ ,用过量的E粉与 FX4高温条件下反应生成金属F,该化学方程式为___________________。
(2)在A与上述元素形成的分子中,中心原子采取sp3杂化的是________________(写出两种)。
(3)下图是BD2分子的晶胞模型,图中显示出的BD2分子数为14个。实际上一个BD2晶胞中含有__________个BD2分子。
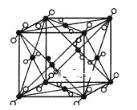
![]() 代表一个BD2分子
代表一个BD2分子
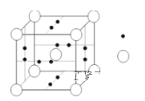
(4)B元素可形成B60单质,从晶体类型来看B60属于__________晶体。科学家把B60与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图(白球(C60)位于立方体的体心和顶点,小黑球(K)则位于立方体的面上),该化合物中B60与钾原子个数比为________________。
(5)已知单晶锗、晶体硅与金刚石的晶体类型完全相同,下图所示是金刚石的晶胞结构,请回答:
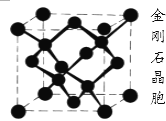
在单晶锗的一个晶胞内含有__________个锗原子。
(6)若向CuSO4溶液中加入少量氨水生成蓝色絮状沉淀,继续加入过量氨水沉淀溶解,得到深蓝色的透明溶液,最后向该溶液中加入一定量的乙醇,所析出晶体的化学式为________。
【答案】1s22s22p63s23p63d24s2 2Mg+TiCl4![]() Ti+2MgCl2 CH4、NH3、H2O 4 分子晶体 1:3 8 [Cu(NH3)4]SO4H2O
Ti+2MgCl2 CH4、NH3、H2O 4 分子晶体 1:3 8 [Cu(NH3)4]SO4H2O
【解析】
A位于第一周期,则A是H或者He,根据提问,A会与其他元素形成化合物,则A为H。B的基态原子有3个不同的能级,各能级中电子数相等,B的电子排布式为1s22s22p2,B为C。D的基态原子2p能级上未成对电子数与B原子相同,且D能形成-2价的离子,则D为O。根据B、C、D原子序数依次增大,C为N元素。O2-和E2+具有相同的核外电子排布,则E为Mg,F4+与Ar原子的核外电子层结构相同,F的原子序数为22,F为Ti。X是第三周期电负性最大的元素,则X为Cl。
(1)F为22号元素Ti,其基态原子的核外电子排布式为1s22s22p63s23p63d24s2;E为Mg,和TiCl4高温下反应生成Ti单质,为置换反应,方程式为2Mg+TiCl4![]() Ti+2MgCl2;
Ti+2MgCl2;
(2)中心原子通过sp3杂化形成分子,则说明中心原子含有4个价电子对,CH4、NH3、H2O都含有4个价电子对,答案为CH4、NH3、H2O;
(3)在CO2的晶胞中,有8个CO2分子位于顶点,为8个晶胞所共有,则有1/8个CO2分子属于这个晶胞;有6个CO2分子位于面上,为2个晶胞所共用,则有1/2个CO2分子属于这个晶胞,所以该晶胞一共有![]() 个CO2;
个CO2;
(4)C60属于一个分子,C60的晶体属于分子晶体;在该晶胞中,有8个C60位于顶点,为8个晶胞所共有,则有1/8个C60属于这个晶胞,则该晶胞中有![]() ;有6个K位于面上,为2个晶胞所共有,则有1/2个K属于这个晶胞,则该晶胞中有
;有6个K位于面上,为2个晶胞所共有,则有1/2个K属于这个晶胞,则该晶胞中有![]() ,则C60与K的比例为1:3;
,则C60与K的比例为1:3;
(5)类似于金刚石的晶胞中,有8个原子位于顶点,为8个晶胞所共有,则有1/8个原子属于这个晶胞;有6个原子位于面上,为2个晶胞所共有,则有1/2个原子属于这个晶胞;有4个原子位于晶胞内,为这个晶胞所独有,完全属于此晶胞,则一共有![]() 个原子;
个原子;
(6)按照题意,深蓝色的透明溶液中含有四氨合铜离子,加入乙醇析出沉淀,此沉淀为[Cu(NH3)4]SO4H2O。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)在25 ℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式:___________________________________。
(2)Zn(s) + 1/2 O2(g) = ZnO(s) ΔH1 = -351 kJ/mol Hg(l) + 1/2 O2(g) = HgO(s) ΔH2 = -91 kJ/mol,由此可知ZnO(s) + Hg(l) = Zn(s) + HgO(s) △H3= __________kJ/mol。
Ⅱ、二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,总反应为:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
CH3OCH3(g) + CO2(g) ΔH = -246.4 kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡。改变下列条件之一,既能提高反应速率,又能提高CO的转化率的是________(填字母代号)。
a 降低温度 b 加入催化剂 c 缩小容器体积 d 增加H2的浓度
(2)该反应的化学平衡常数表达式K = _______________________,升高温度,平衡常数___________(填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3 H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
CH3OCH3(g) + CO2(g),达到平衡后,测得平衡时混合气体的物质的量是同温同压下起始时的1.2倍。
① 反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”)
② 平衡时,n(CH3OCH3) = ________,平衡时CO2的转化率为________。
③ 平衡时,再向原容器中投入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,一段时间后达到新的平衡,此时CO2的转化率与原平衡相比________(填“增大”、 “减小”或 “不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得“863”和中科院“百人计划”支持的绿色环保型铝碘电池已研制成功。电极为铝、石墨,电解液为AlI3溶液,电池总反应:2AlI3 ![]() 2Al +3I2,下列说法中正确的是( ):
2Al +3I2,下列说法中正确的是( ):
A. 放电时的负极反应Al-3e-=Al3+,导线中通过3.612×1024个电子时负极质量减少27g
B. 充电时电子的流动方向:电源负极→Al电极→电解质溶液→石墨电极→电源正极
C. 消耗相同质量的金属时,用锂做负极转移电子的物质的量比用铝时的多
D. 乙醇、乙酸等含活泼氢的有机物可用作该铝碘电池的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中,在不同条件下,既能发生水解反应和消去反应,又能发生酯化反应并能与金属钠反应放出氢气的是 ( )
①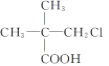 ②
②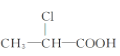 ③
③![]() ④
④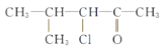
A. ②B. ②③C. ①②D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
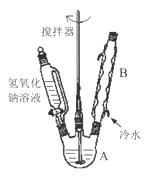
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
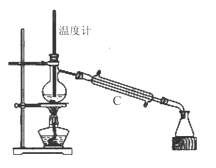
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氢氧化铁胶体以及在胶体中滴加适量HI溶液,其过程如下图所示,下列说法错误的是
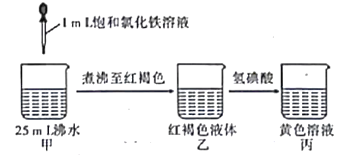
A.氢氧化铁胶体带正电荷,能聚沉水中带负电荷的杂质
B.乙转化为丙过程中发生聚沉、复分解反应、氧化还原反应
C.利用丁达尔效应可验证乙中是否生成了胶体
D.煮沸的目的是促进Fe3+水解生成更多的Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。

(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-==Fe4[Fe(CN)6]3↓(蓝色沉淀)。下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
(5)兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金。碱浸镍铝合金后,残铝量对兰尼镍的催化活性有重大影响,根据下图分析,残铝量在_____范围内催化活性最高,属于优质产品。

(6)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_________________。
(示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。若生成0.5molN2,下列说法不正确的是( )

A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com