
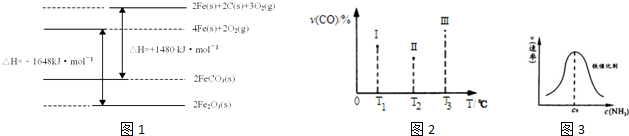
 �ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿���ͼ��ʾ��
�ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿���ͼ��ʾ��
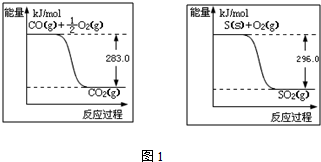
���� ��1��ͼ1������д�Ȼ�ѧ����ʽ�����C��s��+O2��g��=CO2��g����H=-393kJ•mol-1��˹���ɼ���õ�FeCO3�ڿ�������������Fe2O3���Ȼ�ѧ����ʽ��
��2���ٻ�ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��2min��ﵽƽ�⣬���Fe2O3�ڷ�Ӧ����������4.8g�����ݻ�ѧ����ʽ��Ӧǰ�������仯�����������������ʵ��������ݷ�Ӧ���ʸ������õ������ķ�Ӧ���ʣ�
��2Fe��s��+3CO��g��+6H2��g���TFe2O3��s��+3CH4��g��������ͼ2�Т�ͼ��CO�ٷֺ�������С����ϻ�ѧƽ���ƶ�������𣻸����¶ȶ�ƽ���Ӱ�����жϣ������¶�ƽ�������ƶ���CO��ת���ʼ�С���ݴ��ж�Fe2O3��s��+3CH4��g���T2Fe��s��+3CO��g��+6H2��g����H��С��
��3���ٻ�ѧ���Ķ���Ҫ�����������Ҹ÷�Ӧ���ȣ�
��c0ǰ����Ũ�����ӣ����·�Ӧ���ʼӿ죻c0�����ڰ�����Ũ��̫���谭N2��H2�Ľ�����
��� �⣺��1����C��s��+O2��g��=CO2��g����H=-393kJ•mol-1
�����仯���ﷴӦ���ʱ�ʾ��ͼ��ͼ1��д���Ȼ�ѧ����ʽΪ��
��2Fe��s��+2C��s��+3O2��g��=2FeCO3��s����H=+1480KJ/mol��
��4Fe��s��+3O2��g��=2Fe2O3��s����H=-1648KJ/mol
��˹���ɼ���١�4-���ڡ�2-�ۣ��õ�FeCO3�ڿ�������������Fe2O3���Ȼ�ѧ����ʽ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=-260 kJ•mol-1��
�ʴ�Ϊ��4FeCO3��s��+O2��g��=2Fe2O3��s��+4CO2��g����H=-260 kJ•mol-1��
��2���ٻ�ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ��÷�Ӧ��ѧƽ�ⳣ��K=$\frac{{c}^{3}��CO����{c}^{6}��{H}_{2}��}{{c}^{3}��C{H}_{4}��}$��
�ʴ�Ϊ��$\frac{{c}^{3}��CO����{c}^{6}��{H}_{2}��}{{c}^{3}��C{H}_{4}��}$��
��Fe2O3��s��+3CH4��g���T6H2��g��+2Fe��s��+3CO��g��
1mol 6mol
$\frac{4.8g}{160g/mol}$ n
1mol��6mol=$\frac{4.8g}{160g/mol}$��n
n=0.18mol
������ʾ�ķ�Ӧ����=$\frac{\frac{0.18mol}{3L}}{2min}$=0.03 mol•L-1•min-1��
�ʴ�Ϊ��0.03 mol•L-1•min-1��
�����ݻ���ΪVL�Ģ�������ͬ�ܱ������м����������������Ľ�������Ȼ��ֱ����a molCO��2amol H2��2Fe��s��+3CO��g��+6H2��g���TFe2O3��s��+3CH4��g��������ͼ2�Т�ͼ��CO�ٷֺ�������С��������Ϊ����T1�е�״̬ת���T2�е�״̬��CO�ٷֺ�����С��˵��ƽ�������ƶ���˵��T1δ��ƽ��״̬��T2�е�״̬ת���T3�е�ƽ��״̬��CO�ٷֺ�������˵��ƽ�������ƶ���˵��T2���ܴ�ƽ��״̬��һ���ﵽ��ѧƽ��״̬���Ǣ�2Fe��s��+3CO��g��+6H2��g���TFe2O3��s��+3CH4��g�����÷�Ӧ����ӦΪ���ȷ�Ӧ��������ӦFe2O3��s��+3CH4��g���T2Fe��s��+3CO��g��+6H2��g���ġ�H��0��
�ʴ�Ϊ��III��С�ڣ�
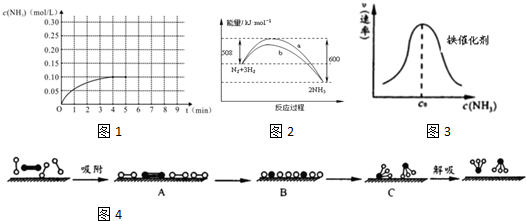
��3�������ڻ�ѧ���Ķ���Ҫ�����������ʻ״̬B���������ڳ�ʼ״̬A�����������˷�ӦΪ���ȷ�Ӧ���ʳ�ʼ״̬A����������ĩ̬C����������C��������ͣ�
�ʴ�Ϊ��C��
��c0ǰ����Ũ�����ӣ����·�Ӧ���ʼӿ죻c0�����ڰ�����Ũ��̫���谭N2��H2�Ľ������ʷ�Ӧ���ʼ�����
�ʴ�Ϊ����������NH3Ũ�ȵ����ӣ����������������ߣ�����NH3Ũ�����ӣ�NH3�ķֽ����ʼӿ죻���������ﵽ���ͣ�ͬʱ�����ڽ�����NH3�ķֽ����ʽ��ͣ�
���� ���⿼�黯ѧƽ����㡢��ѧƽ��Ӱ�����ء���˹���ɵ�֪ʶ�㣬Ϊ��Ƶ���㣬���ؿ���ѧ��������������������ȷ��������Ի�ѧƽ���ƶ�Ӱ��ԭ������˹����ԭ���ǽⱾ��ؼ����ѵ��ǣ�2���۵��жϣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��� | �������� g | ����״̬ | c��H2SO4�� mol•L-1 | V��H2SO4�� mL | ��Һ�¶�/�� | ������ʧ�� ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ˿ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | ˿ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | ˿ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | ˿ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | ˿ | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | ˿ | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | ˿ | 1.1 | 50 | 30 | 44 | 40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S��SO2��SO3��H2SO4 | B�� | Fe��FeCl2��Fe��OH��2��Fe��OH��3 | ||
| C�� | Al��Al2O3��Al��OH��3��NaAlO2 | D�� | N2��NO��NO2��HNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��Ba2+��NO3-��Cl- | B�� | K+��Na+��H+��Cl- | ||
| C�� | K+��NH4+��S2-��CO32- | D�� | Cu2+��Na+��Cl-��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ4��ʾ��
�ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ4��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.64 | 0.50 | 0.50 |
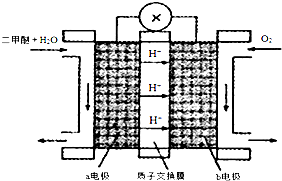
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
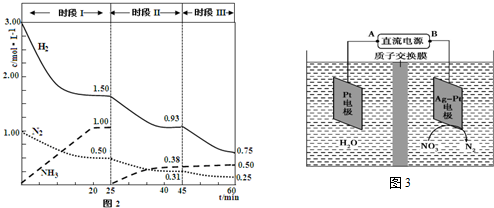
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
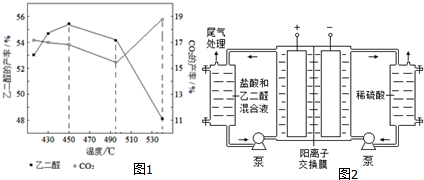
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
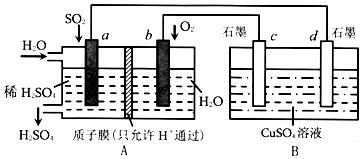
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com