
分析 (1)2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-88kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)×$\frac{1}{2}$ 得SO3(g)与H2O(l)反应的热化学方程式;
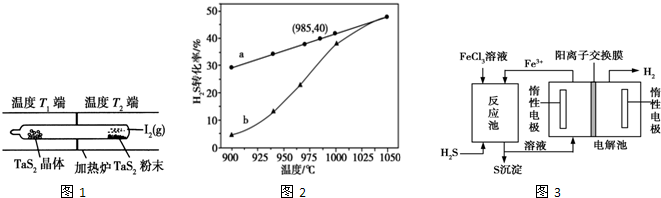
(2)设 I2的平衡转化率为x,则参加反应的I2为xmol,由方程式可知,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,根据K=$\frac{c(TaI{\;}_{4})×c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$=1列方程计算;
该反应为吸热反应,温度T2端利于反应正向进行,应为高温,温度T1端利于反应向左进行,应为低温,反应中I2是可以循环使用的物质;
(3)①由图可知,随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,正反应为吸热反应;
温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短;
②反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;电解池中亚铁离子失去电子,氢离子得到电子,以此来解答.
解答 解:(1)2SO2(g)+O2(g)2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-88kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)×$\frac{1}{2}$ 得SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
(2)设 I2的平衡转化率为x,则参加反应的I2为xmol,由方程式可知,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,则K═$\frac{c(TaI{\;}_{4})×c(S{\;}_{2})}{c{\;}^{2}(I{\;}_{2})}$=$\frac{0.5x×0.5x}{(1-x){\;}^{2}}$=1,解得:x=66.7%;
该反应为吸热反应,一段时间后,在温度为T1的一端得到了纯净TaS2晶体,温度T2端利于反应正向进行,应为高温,温度T1端利于反应向左进行,应为低温,所以T1<T2,I2是可以循环使用的物质;
故答案为:66.7%;<;I2;
(3)①由图可知,随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,正反应为吸热反应,所以△H4>0;
温度的升高,反应速率加快,达到平衡时的时间缩短,曲线b向曲线a逼近,
故答案为:>;温度升高,反应速率加快,达到平衡所需的进间缩短;
②反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+ $\frac{\underline{\;通电\;}}{\;}$2Fe3++H2↑,
故答案为:增大反应物接触面积,使反应更充分;2Fe2++2H+ $\frac{\underline{\;通电\;}}{\;}$2Fe3++H2↑.
点评 本题考查热化学方程式的书写、化学平衡有关计算与影响因素、化学平衡图象、电解原理等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 39g苯中含有C═C键数为1.5NA | |
| B. | 0.5molFeBr2与标准状况下33.6L氯气反应时转移电子数为3NA | |
| C. | 1L0.5mol•L-1的NaClO溶液中含有的ClO-离子数为0.5NA | |
| D. | 常温常压下,14g由C2H4和C3H6组成的混合气体中含有的原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中反应达到平衡时,Q1=Q | |
| B. | 达到平衡后,甲中C的体积分数比乙大 | |
| C. | 达到平衡后,再向乙中加入0.25molA、0.75molB、1.5molC,平衡向生成C的方向移动 | |
| D. | 乙中的热化学反应方程式为2C(g)?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应C(s)+H2O(g)═CO(g)+H2(g)不能自发进行,则该反应的△H>0 | |
| B. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0,△S<0 | |
| C. | 放热的自发过程,一定是熵增加的过程 | |
| D. | 液态水可自发挥发成水蒸气的过程是熵减的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
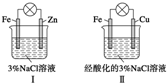
| A. | Ⅰ中不能形成原电池 | |
| B. | Ⅱ中负极反应是Fe-3e-═Fe3+ | |
| C. | Ⅱ中正极反应是O2+2H2O+4e-═4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B.
B. C.
C. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
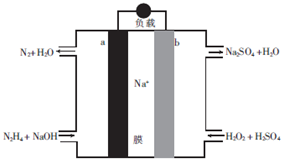
| A. | a极为电池的正极 | |
| B. | 电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 | |
| C. | b极的电极反应式为H2O2+2e-=2OH- | |
| D. | 用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com