
A~H 8种物质的转化关系如下图所示(部分生成物略去)。化合物B中阴阳离子数目之比为2∶1,C是无色有刺激性气味的气体,C、D的分子均为10电子微粒。

请回答下列问题:
(1)写出F、H的化学式:F ,H 。
(2)反应①的离子方程式为 ,反应②的化学方程式是 。
(3)在反应①~⑤中,属于氧化还原反应的是 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
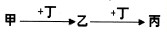
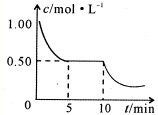
查看答案和解析>>
科目:高中化学 来源: 题型:
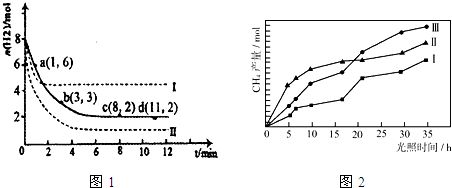
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.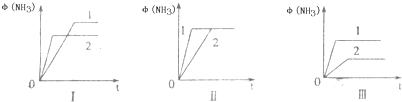
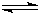 H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| △ |
| ||
| △ |
| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com