
| A. | 18.8g苯酚中含有碳碳双键的个数为0.6NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 标准状况下,11.2L 三氯甲烷所含分子数为0.5NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
分析 A、苯环不是碳碳双键的结构;
B、依据n=$\frac{m}{M}$计算物质的量,结合羟基结构计算电子数;
C、标况下,三氯甲烷为液态;
D、葡萄糖和冰醋酸最简式相同为CH2O,只需要计算3.0gCH2O的物质的量计算原子数;
解答 解:A、苯环不是碳碳双键的结构,不含碳碳双键,故A错误;
B、依据n=$\frac{m}{M}$计算物质的量=$\frac{17g}{17g/mol}$=1mol,结合羟基结构计算电子数9NA个,故B错误;
C、标况下,三氯甲烷为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、葡萄糖和冰醋酸最简式相同为CH2O,只需要计算3.0gCH2O的物质的量计算原子数=$\frac{3.0g}{30g/mol}$×4×NA=0.4NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙 | |
| B. | 对苯二甲酸(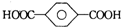 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (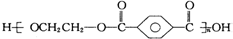 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. | 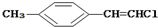 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
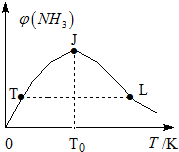 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
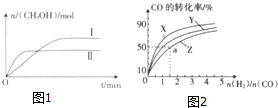 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | H2→2H | ||
| C. | CaO+H2O=Ca(OH)2 | D. | 2Cl→Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com