
| 溶质 | NaHSO3 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 5.8 | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| 序号 | Ba(OH)2溶液体积/mL | 盐酸体积/mL | 混合液pH |
| 1 | 22.00 | 0 | 10 |
| 2 | 22.00 | 18.00 | 9 |
| 3 | 22.00 | 22.00 | 8 |
分析 (1)①多元弱酸的正盐水解呈碱性,第一步水解生成的OH-对第二步有抑制作用;
②都为弱酸的盐溶液,pH越大,说明水解程度越大,则对应的酸越弱;
(2)在t℃,某Ba(OH)2稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,且a+b=16,可知Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-16,Ba(OH)2溶液的pH=10,可知c(OH-)=10-6mol/L,加入盐酸体积为22mL时,pH=8,说明呈中性,则c(H+)=c(OH-).
解答 解:(1)①多元弱酸的正盐水解呈碱性,因第一步水解生成的OH-对第二步有抑制作用,则第一步水解比第二步水解程度大得多,
故答案为:第一步水解生成的OH-对第二步有抑制作用;
②都为弱酸的盐溶液,pH越大,说明水解程度越大,则对应的酸越弱,由pH可知酸性H2SO3>CH3COOH>H2CO3>HClO>HCN>C6H5OH>HCO3-,反应时应遵循强酸制备的原则,不能发生的为ab,
故答案为:ab;
(2)在t℃,某Ba(OH)2稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,且a+b=16,可知Kw=c(H+)×c(OH-)=10-a×10-b=10-(a+b)=10-16,则中性时溶液pH=8,Ba(OH)2溶液的pH=10,可知c(OH-)=10-6mol/L,加入盐酸体积为22mL时,pH=8,说明呈中性,则c(H+)=c(OH-)=10-6mol/L,
故答案为:10-6mol/L.
点评 本题以离子积常数为载体考查酸碱混合溶液定性判断,为高频考点,水的离子积常数与温度有关,注意酸或碱中水电离出的氢离子或氢氧根离子计算方法,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 添加A物质 | B. | 升高体系温度 | C. | 及时分离出C物质 | D. | 减少B物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+ | |
| C. | 向碳酸氢铵溶液中加过量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-COOH | B. | CH2=CH-CH2OH | C. | CH2=CH-CHO | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中,c(H+)•c(OH-)=1×10-14 | |
| B. | 纯水或水溶液中25℃时,c(H+)•c(OH-)=1×10-14 | |
| C. | NaOH溶液在25℃时,c(H+)•c(OH-)>1×10-14 | |
| D. | 溶液浓度改变或酸碱度改变,Kw随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
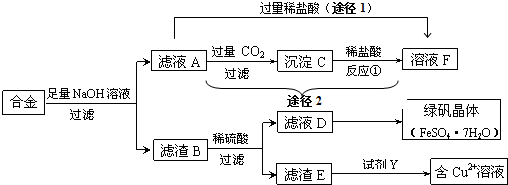
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4,反应转移的电子总数为3mol | |
| B. | Fe2+和S2O32-都是还原剂 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | x=6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com