
【题目】H2O2是一种常用绿色氧化剂,在化学研究中应用广泛
(1)常温下,用CO、O2和水在三苯基膦肥钯的催化下即可制得H2O2。相对于电解氢氧化钠溶液制H2O2,该方法的优点是最安全、___。
(2)图1是铝/过氧化氢电池结构示意图,铝电极为_________(填“正极”或“负极”)。石墨电极的电极反应式为_______________-
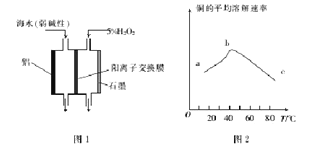
(3)印刷电路板中的金属铜可用10%的H2O2 溶液和0.3mol·L-1的H2SO4溶液处理,其他条件相同时,测得铜的平均溶解速率与温度的关系如图2所示,其中bc段曲线变化的主要原因是_________.
(4)为研究硫酸铁的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验。将表中所给的溶液分别加入A、B、C、D4个反应瓶中,手机产生的气体,记录数据
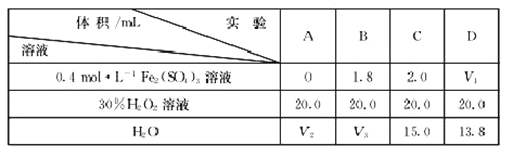
①记录的数据为__________。
②上表中的V3=__________。
【答案】(1)能耗低(其他合理答案均可)(2分);(2)负极(1分);H2O2+2e-==2OH-(2分);
(3)随着温度的升高,H2O2的分解速率加快(2分);
(4)①收集相同体积气体所需的时间(或相同时间内收集气体的体积)(1分);②15.2(2分)。
【解析】
试题分析:(1)电解法需消耗电能,而催化法常温下即可进行,而CO、O2和水在三苯基膦钯的催化下室温制得了H2O2,不需要额外提供能量,该方法的优点是最安全、能耗低;(2)铝较活泼,作负极,石墨作正极,双氧水得电子,氧的化合价降低,电极反应式为H2O2+2e-=2OH-;(3)图象显示,温度升高到40℃以后,铜的平均溶解速率降低,是因为双氧水不稳定,温度升高,分解速率加快,反应物双氧水的浓度降低,导致铜的平均溶解速率降低。故bc段曲线变化的主要原因是随着温度的升高,双氧水的分解速率加快;(4)①研究硫酸铁的量对过氧化氢分解速率的影响,需要记录收集相同体积气体所需的时间(或相同时间内收集气体的体积);②研究硫酸铁的量对过氧化氢分解速率的影响,其他条件要相同,所以让每次实验的总体积相同,从C中得出溶液的总体积为37.0mL,所以V3=37.0mL-1.8mL-20.0mL=15.2mL。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氢氟酸、浓硝酸、硅酸钠溶液依次保存在棕色玻璃瓶、无色细口瓶、带胶塞细口瓶中
B.钠着火时不能用泡沫灭火器灭火
C.用饱和碳酸钠溶液除去CO2中混有的HCl
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用.以下是某研究小组开发的生产PC的合成路线:
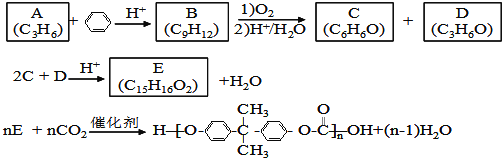
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应;
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰.
请回答下列问题:
(1)A的化学名称是___________;
(2)B的结构简式为___________;
(3)C与D反应生成E的化学方程式为___________;
(4)D有多种同分异构体,其中能发生银镜反应的是___________(写出结构简式);
(5)B的同分异构体中含有苯环的还有___________种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是___________(写出结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的最外层电子数比内层电子数多1,Y是短周期元素中金属性最强的元素,Z的最外层电子数与次外层电子数之比为3:4。
(1)Y的原子结构示意图为_____________。
(2)W的最高价氧化物对应水化物的化学式为__________。Y和W形成的化合物的电子式为______。
(3)隔绝空气加热,Y单质可与X的氧化物反应制备X单质,该反应的化学方程式为______________
(4)0.2mol化合物Z2W2与水反应转移电子的物质的量为0.3mol,生成一种能使品红溶液褪色的气体,该反应过程中只有一种元素化合价发生变化,该反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.蒸馏、萃取、分液 B.分液、萃取、蒸馏
C.萃取、蒸发、分液 D.分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在金刚石、CS2、N2、C2H4、H2O2、金属Fe 等六种晶体中:
(1)以非极性键结合的非极性分子是______________;
(2)通过非极性键形成的原子晶体是______________;
(3)含有极性共价键和非极性共价键的非极性分子是______________;
(4)固态和熔融状态下都能导电的晶体是______________;
Ⅱ、C和Si元素在化学中占有极其重要的地位.
(1)CO2属于______________晶体,熔化时克服的微粒间作用力是______________;SiO2属于______________晶体,熔化时克服的微粒间作用力是______________;所以熔点CO2 ______________SiO2(填“<”、“=”或“>”).
(2)SiO2晶体中每个硅与______________个O相连,每个氧与______________Si相连.
(3)石墨晶体中,层内形成正六边形的平面网状结构,试分析层内每个正六边形占有的碳原子数为___________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)
![]()
![]()
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种T艺流程如下:
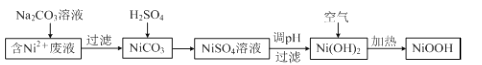
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
过滤时需用到的玻璃仪器有烧杯、 。
(2)写出碳酸镍与稀硫酸反应的离子方程式: 。
(3)硫酸镍溶液可用于制备合成氨的催化剂CoNi(1-n) Fe2O4。 如图表示在其他条件相同时合成氨的相对初始速率随催化剂中w值变化的曲线,由图分析可知Co2+、Ni2+两种离子中催化效果更好的是 。
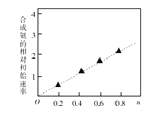
(4)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__ _。
(5)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOHyNi(OH)2。现称取9.18g样品溶于稀硫酸,加入100mL1.0mol/LFe2+标准溶液,搅拌至溶液澄清,定容至200mL。取出20.00mL,用0.010molL﹣1 的KMnO4标准溶液滴定,用去KMnO4标准溶液20.00mL,试通过计算确定x:y= 。[已知反应(未配平):NiOOH+Fe2++H+=Ni2++Fe3++H2O,Ni2+ +MnO4 -+H+![]() Ni3++ Mn2++H2O]
Ni3++ Mn2++H2O]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com