
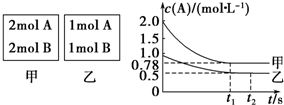
分析 (1)乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,根据A和B的关系式知,参加反应的B的物质的量也是0.5mol,则B的转化率=$\frac{0.5mol/L}{1mol/L}×100%$;
(2)计算甲、乙容器中A的转化率,再根据压强对A转化率的影响来确定x值;
(3)根据化学平衡常数K=$\frac{c(C)}{c(A).c(B)}$;
(4)A.A的浓度不变,则平衡不移动;
B.升高温度,平衡向吸热反应方向移动;
C.若向甲容器中再充入2molA、2molB,相当于增大压强,A在转化率比原来大.
解答 解:(1)乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,根据A和B的关系式知,参加反应的B的物质的量也是0.5mol,则B的转化率=$\frac{0.5mol/L}{1mol/L}×100%$=50%,故答案为:50%;
(2)甲容器反应达到平衡后,c(A)=0.78 mol•L-1,A的转化率=$\frac{(2.0-0.78)mol/L}{2mol/L}×100%$=61%,乙容器中,A参加反应的物质的量=(1-0.5)mol/L×1L=0.5mol,A的转化率=$\frac{0.5mol/L}{1mol/L}×100%$=50%,即压强越大,A的转化率越高,所以正反应为气体体积减小的反应,则x=1,故答案为:1;
(3)反应达到平衡时,乙容器中c(A)=c(B)=c(C)=0.5 mol•L-1,T℃时,该反应的平衡常数K=$\frac{c(C)}{c(A).c(B)}$=$\frac{0.5}{0.5×0.5}$=2,故答案为:2;
(4)A.向平衡后的乙容器中充入惰性气体氦气,气体的浓度不变,平衡不发生移动,所以c(A)不变,故A错误;
B.将乙容器单独升温,平衡逆向移动,A的体积分数增大,更大于甲容器中A的体积分数,故B错误;
C.若向甲容器中再充入2 mol A、2 mol B,相当于增大压强,平衡向正反应方向移动,则达到平衡时A的转化率比不加前增大,所以平衡时甲容器中0.78 mol•L-1<c(A)<1.56 mol•L-1,故C正确;
故答案为:C.
点评 本题考查了化学平衡的移动、化学平衡的计算、等效平衡等知识点,根据图象计算转化率,根据转化率计算x值,再结合等效平衡及影响化学平衡的因素来分析(4),注意等效平衡的应用,难度中等.


科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO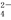 、NO
、NO
B.无色溶液中可能大量存在Al3+、NH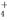 、Cl-、S2-
、Cl-、S2-
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO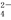
D.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
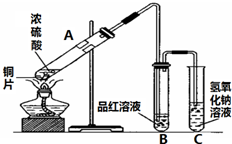 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
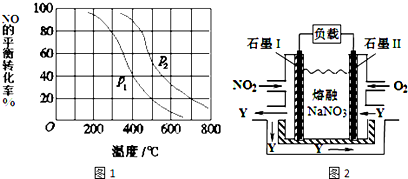
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
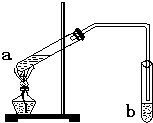 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 运用所学知识,解决下列问题:
运用所学知识,解决下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
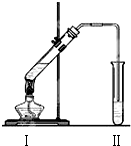 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
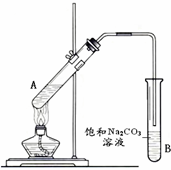 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
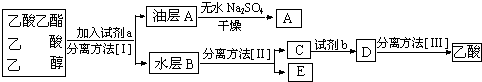
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com