
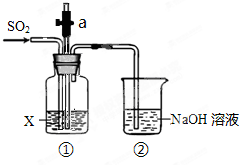
 某同学用如图所示装置探究SO2的性质.
某同学用如图所示装置探究SO2的性质.

科目:高中化学 来源: 题型:
| A、两溶液中由水电离的c(H+)前者小于后者 |
| B、两溶液分别和足量的锌反应,生成氢气的体积相等 |
| C、两溶液分别和相同的锌反应,生成氢气的起始速率相等 |
| D、两溶液分别和与其体积相等的、pH=12的NaOH溶液混合后,都呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性强弱顺序为XO42->Z2>R2>M3+ |
| B、还原性强弱顺序为X2+>Z->R->M2+ |
| C、R元素在反应②中被氧化,在③中被还原 |
| D、常温下反应2M2++Z2═2M3++2Z-不可进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是否为大量分子或离子的集合体 |
| B、分散质微粒的大小不同 |
| C、能否通过滤纸或半透膜 |
| D、是否均一、稳定、透明 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com