
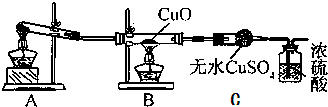
分析 [实验探究]
(1)实验室制取氨气根据盐和碱的复分解反应的原理,常用氯化铵固体与熟石灰固体混合加热,生成氯化钙,水和氨气,依此确定大试管中应加入的药品;
(2)氨气是碱性气体,极易溶于水,做氨气干燥剂的物质不能和氨气反应,所以干燥氨气的物质应为碱性或中性;C装置中氨气还原氧化铜生成的产物水使白色硫酸铜变蓝色;
[交流讨论]
依据氧化亚铜在酸溶液中发生自身氧化还原反应,生成铜离子和金属铜,设计实验方法验证红色固体中是否含有Cu2O,不能用强氧化性的酸;依据铜元素守恒结合反应物、生成物质量间的关系分析解答;
[拓展延伸]
根据化学方程式结合氧化铜和水之间的质量情况进行计算.
解答 解:[实验探究]
(1)A装置是氨气的发生装置,实验室制取氨气,通常采用氯化铵和氢氧化钙发生复分解反应,生成氯化钙、氨气和水制得氨气,化学反应方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,所以实验前大试管中应加入的药品是NH4Cl、Ca(OH)2,
故答案为:NH4Cl、Ca(OH)2;
(2)氨气是碱性气体,极易溶于水,做氨气干燥剂的物质不能和氨气反应,碱石灰显碱性,不与氨气反应,可用于干燥氨气,B装置中的现象为黑色固体变成红色,氨气与氧化铜反应生成铜、水、氮气,C装置中水和白色硫酸铜反应生成蓝色五水合硫酸铜,
故答案为:碱石灰;无水硫酸铜变蓝;
[交流讨论]
氧化亚铜在酸溶液中发生自身氧化还原反应,生成铜离子和金属铜,用最简便的实验方法证明红色固体中是否含有Cu2O,实验设计为:取固体样品少许,溶解于稀硫酸溶液中,若溶液呈蓝色,证明红色固体中含有Cu2O,不能用强氧化性的酸浓硝酸、稀硝酸,
故答案为:稀硫酸;
单质铜在空气中加热生成氧化铜,质量增加,氧化铜高温分解生成氧化亚铜和氧气,所以若确认红色固体中只含有Cu,则经高温灼烧后得到的物质是氧化亚铜,氧化亚铜的质量为(c-a)g,铜元素的质量为$\frac{128}{144}$,所取固体质量为(b-a)g,若确认红色固体中含有Cu2O,红色固体为
铜和氧化亚铜的混合物,则铜的质量应小于(b-a)g,即$\frac{128}{144}$<(b-a)g,解得:c<$\frac{9b-a}{8}$,
故答案为:Cu2O;$\frac{9b-a}{8}$;
[拓展延伸]
设铜的相对原子质量为x
2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
3(x+16)54
m(CuO) m(H2O)
解得:x=$\frac{18m(CuO)-16m({H}_{2}O)}{m({H}_{2}O)}$,
故答案为:$\frac{18m(CuO)-16m({H}_{2}O)}{m({H}_{2}O)}$.
点评 本题考查了实验制备物质的实验过程和反应现象的分析应用,物质检查的方法设计,物质性质和实验基本操作是解题关键,题目难度中等,注意分析题给的条件,注意测定生成水的质量来测铜的相对原子质量.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:实验题
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
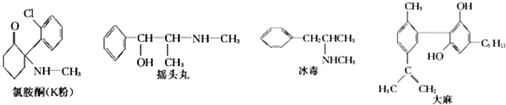
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com