
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I CO2(g)+H2(g)?CO(g)+H2O(g)△H2Ⅱ| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
分析 ②已知:CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1,②H2O(1)═H2O(g)△H3=44.0kJ•mol-1,可知热化学方程式
a.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
b.H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H=-285.8kJ•mol-1,
c.H2O(1)═H2O(g)△H3=44.0kJ•mol-1,利用盖斯定律可计算CO2(g)+H2(g)?CO(g)+H2O(g)的反应热;
加入催化剂,可降低反应的活化能,催化能力越强,活化能越低,但反应热不变.
解答 解:②已知:CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1,②H2O(1)═H2O(g)△H3=44.0kJ•mol-1,可知热化学方程式
a.CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1,
b.H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H=-285.8kJ•mol-1,
c.H2O(1)═H2O(g)△H3=44.0kJ•mol-1,由盖斯定律将b-a+c可得:CO2(g)+H2(g)?CO(g)+H2O(g)△H2 =(-285.8+283.0+44)kJ•mol-1=+41.2kJ•mol-1,
故答案为:+41.2;
从表中数据分析,在催化剂Cat.2的作用下,甲醇的选择性更大,说明催化剂Cat.2对反应Ⅰ催化效果更好,催化剂能降低反应的活化能,说明使用催化剂Cat.2的反应过程中活化能更低,故图为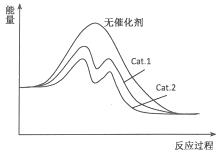 ,
,
故答案为: .
.
点评 本题考查反应热的计算,据催化剂,可降低反应的活化能,但反应热不变进行绘图,本题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.
TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | B. | pH增大2个单位 | ||
| C. | 溶液中c(OH-)减小 | D. | Kw减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉已完全水解;在淀粉水解液中滴加碘水 | |
| B. | 证明氧化性H2O2比Fe3+强,将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | |
| C. | 检验某溶液中含Fe2+:可先向溶液中加入氯气,再滴加少量KSCN溶液 | |
| D. | 把0.9mol•L-1硫酸100mL;将18 mol•L-1硫酸5mL移入100mL容量瓶,加水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
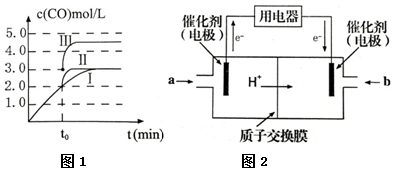
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 停止北方冬季供暖,减少有害物质排放 | |
| B. | 寻找新能源,减少化石燃料的使用 | |
| C. | 退耕还林,改善生态环境 | |
| D. | 对锅炉和汽车等产生的有害气体和烟尘等进行处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了防止白色污染应回收废旧塑料并加以焚烧 | |
| B. | 手机壳上贴的碳纤维膜是一种新型无机非金属材料 | |
| C. | 当今雾霾天气频发是由于人类活动对自然环境的影响所造成的 | |
| D. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应SiO2(s)+3C(s)═SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H>0 | |
| B. | 等pH的CH3COOH、HCl溶液混合后,平衡不移动,但c(CH3COO-)减少 | |
| C. | 配制KF溶液时,必需要加入KOH溶液抑制F-水解 | |
| D. | 向NaHS溶液中滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度增大,pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com