
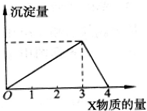
 将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为Al2(SO4)3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、CO2是氧化产物 |
| B、H2C2O4在反应中被氧化 |
| C、1mol H2C2O4参加反应,转移的电子为1mol |
| D、H2C2O4的氧化性强于ClO2的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al(OH)3是难溶于水的白色沉淀 |
| B、Al(OH)3能吸附水中的悬浮物 |
| C、Al(OH)3能溶于氨水 |
| D、Al(OH)3属于两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①②中除加试剂外,还需要进行过滤操作 |
| B、a、b中铝元素的化合价不相同 |
| C、③中需要通入过量的CO2 |
| D、④进行的操作是加热,而且d一定是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释浓硫酸时,需将酸沿着烧杯壁注入水中,并不断用玻璃棒搅拌 |
| B、称量固体药品时,可以在托盘中直接称量 |
| C、制取乙烯时,温度计的位置应在混合液的正上方 |
| D、氢氟酸可以存放在玻璃器皿中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com