
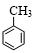
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$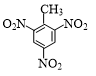 +3H2O.
+3H2O.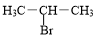 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$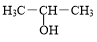 +NaBr.
+NaBr.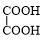 +
+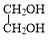 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O. 分析 (1)检验甲苯中含有的酒精,利用酒精能和钠反应,而甲苯不能进行检验;
(2)除去甲烷中混有的乙烯,利用甲烷不能和溴单质反应,而乙烯能和溴发生加成反应进行除杂:
(3)甲苯在浓硫酸作用下可与浓硝酸发生取代反应生成TNT;
(4)2-溴丙烷在氢氧化钠的水溶液中发生取代反应生成2-丙醇和溴化钠;
(5)将1-丙醇转化为丙醛,醇羟基被氧化成醛基;
(6)乙二醇与乙二酸转化为六元环状酯,酸脱羟基、醇脱氢.
解答 解:(1)酒精能和钠反应,而甲苯不能,加入钠反应为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,甲苯中含有的酒精,否则无,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;
(2)因为甲烷不和溴水反应,而乙烯能和溴水发生加成反应而使溴水退色,且生成的CH2BrCH2Br为液态,便于分离,所以除去甲烷中混有的乙烯,通过溴水,反应为:CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
(3)甲苯在浓硫酸作用下可与浓硝酸反应生成TNT,反应的化学方程式为 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,
+3H2O,
故答案为: +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;
(4)2-溴丙烷在氢氧化钠的水溶液中发生取代反应生成2-丙醇和溴化钠,反应的化学方程式为: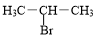 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr,
+NaBr,
故答案为: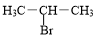 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr;
(5)1-丙醇中含-OH,能发生催化氧化生成丙醛,其反应方程式为:2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O,
故答案为:2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O;
(6)酯化反应酸脱羟基、醇脱氢,乙二酸与乙二醇反应生成六元环状酯的方程式为: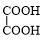 +
+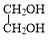 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O,
+2H2O,
故答案为: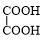 +
+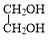 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,注意有机反应的条件,题目难度中等,注意对有机反应机理的理解.


科目:高中化学 来源: 题型:解答题
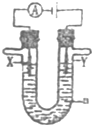 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
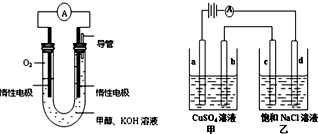
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与H2O反应,转移的电子总数为0.1NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
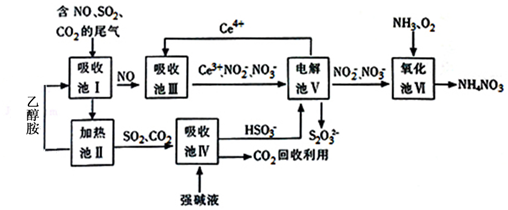
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
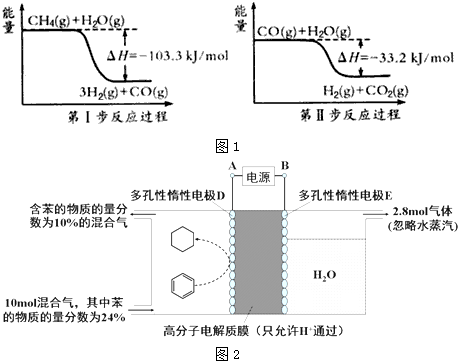
 $?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$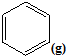 +3H2(g)
+3H2(g)查看答案和解析>>
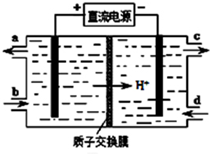
科目:高中化学 来源: 题型:选择题
| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液的pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002NA个电子时,两极共产生0.002 mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
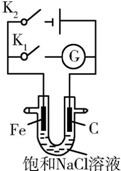
 苯甲酸(
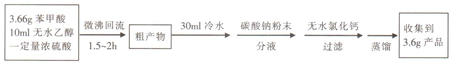
苯甲酸(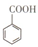 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率.据此某实验小组设计了如下图的装置来进行上述实验.相关信息如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解度 | |
| 苯甲酸 | 122 | 1.27 | 249 | 微溶 |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 苯甲酸乙酯 | 150 | 1.05 | 212.6 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中;c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3mol•L-1 | |
| B. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| C. | NH4HSO3溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 等浓度、等体积的Na2CO3和NaHCO3混合:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com