
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
分析 根据盖斯定律②×$\frac{3}{2}$-①得:2Fe(s)+O2(g)=Fe2O3(s),焓变也乘以相应的数值进行加减,据此进行解答.
解答 解:已知:①Fe2O3(s)+$\frac{3}{2}$C(s)=$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.1kJ•mol-1
②C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
由盖斯定律,②×$\frac{3}{2}$-①,得:2Fe(s)+O2(g)=Fe2O3(s)△H=(-393.5kJ•mol-1)×$\frac{3}{2}$-(+234.1kJ•mol-1)=-824.35kJ•mol-1,
故选A.
点评 本题考查了盖斯定律在热化学方程式中的应用,题目难度中等,明确盖斯定律的内容为解答关键,注意熟练掌握盖斯定律在热化学方程式中的应用方法,试题培养了学生的灵活应用能力.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
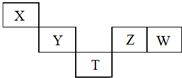 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
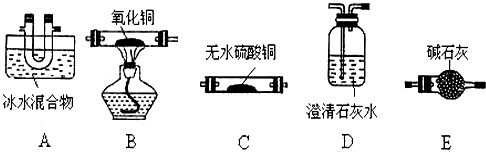
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
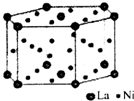 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
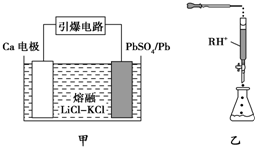
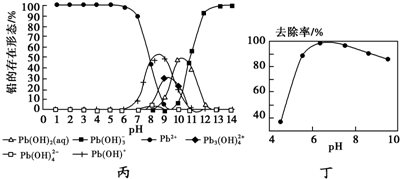
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
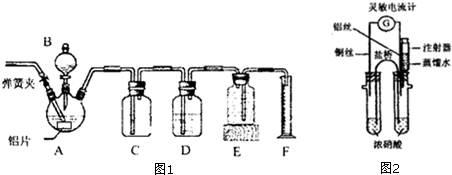
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
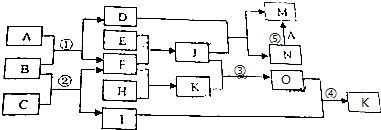
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com