
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。用下图所示装置进行第一组实验。

(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是_____(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N 极发生反应的电极反应式为______。
【答案】A 2H++2e-=H2↑(或2H2O+2e﹣=H2↑+2OH﹣)
【解析】
图中,左边装置是原电池,较活泼的金属锌作负极,较不活泼的金属铜作正极,如果要找电极材料代替铜,所找材料必须是不如锌活泼的金属或导电的非金属,M是阳极,N是阴极,电解池中阴极上阳离子得电子发生还原反应,原电池放电时,阴离子向负极移动,据此分析。
(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,故答案为:A;
(2)N电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑(或2H2O+2e﹣=H2↑+2OH﹣),故答案为:2H++2e-=H2↑(或2H2O+2e﹣=H2↑+2OH﹣)。


科目:高中化学 来源: 题型:
【题目】醋酸的下列性质中,可以证明它是弱电解质的是( )
![]() 大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;
大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;![]() 醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
A.②④⑤⑥B.②④⑥C.①②④D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
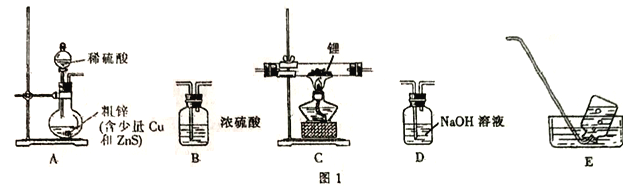
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。

(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________。尖嘴部分应____________________________。用去的标准盐酸的体积是_____________mL

(2)该实验应选用_____作指示剂;操作中如何确定终点?______________________________。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等有重要意义。
(1)用CO可以合成甲醇,已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
O2(g)=CO2(g)+2H2O(l) △H=-764.5 kJmol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJmol-1;
O2(g)=CO2(g) △H=-283.0 kJmol-1;
H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJmol-1;
O2(g)=H2O(l) △H=-285.8kJmol-1;
则CO(g)+2H2(g)![]() CH3OH(g) △H=___kJmol-1。
CH3OH(g) △H=___kJmol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是___(填写序号)。
a.使用催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醛,平衡转化率与温度、压强的关系如图1所示。
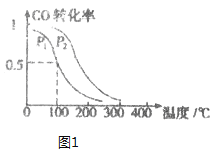
①P1___P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=______;
③100℃,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2、CH3OH各0.5a mol,则平衡___(填“向左”“不”或“想右”)移动。
(4)利用原电池原理,用SO2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触,请写出该电池的负极的电极反应式___;
(5)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为______。用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液,电解原理示意图如图2所示。请写出该电解池发生反应的化学方程式___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解答下列问题:
Ⅰ.某同学做如下实验![]() 图
图![]() ,以检验反应中的能量变化。
,以检验反应中的能量变化。
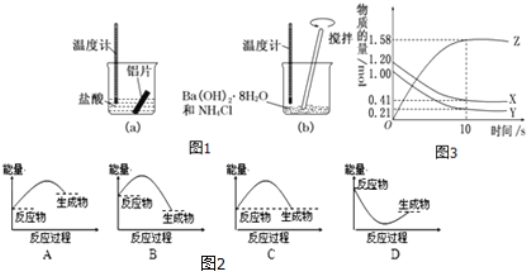
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是 ______ 热反应;该反应中 ______ 能转化成 ______ 能。
(2)(b)中温度降低,下列各图![]() 图
图![]() 所表示的反应是(b)反应的是 ______ 。
所表示的反应是(b)反应的是 ______ 。
Ⅱ.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图3所示。
(1)该反应中 ______ 是反应物,反应是 ______ 反应。
(2)反应开始到10s,用Z表示的反应速率为 ______ ![]() 。
。
(3)反应开始到10s时,Y的物质的量浓度减少了 ______ ![]() 。
。
(4)反应的化学方程式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
I.现有反应:①![]() ,②
,②![]() 。
。
(1)两反应中属于吸热反应的是______![]() 填序号
填序号![]() 。
。
(2)![]() 原电池的装置如图所示。
原电池的装置如图所示。
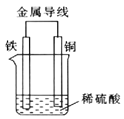
①溶液中![]() 向______
向______![]() 填“铁”或“铜”
填“铁”或“铜”![]() 电极方向移动。
电极方向移动。
②正极的现象是______,负极的电极反应式为______。
![]() 某可逆反应:
某可逆反应:![]() 在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 |
|
|
|
|
|
| |
2 | 800 |
|
|
|
|
|
|
|
3 | 950 |
|
|
|
|
|
|
|
(3)实验1中,在![]() min内,以物质A表示的平均反应速率为______
min内,以物质A表示的平均反应速率为______![]() ,50min时,
,50min时,![]() 正
正![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 逆
逆![]() 。
。
(4)0~20min内,实验2比实验1的反应速率______![]() 填“快”或“慢”
填“快”或“慢”![]() ,其原因可能是______。
,其原因可能是______。
(5)实验3比实验1的反应速率快,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化合物的名称或结构简式:
(1)结构简式为 的烃可命名为:________________________________。
的烃可命名为:________________________________。
(2)结构简式为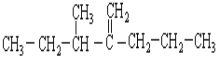 此烃名称为____________________________。
此烃名称为____________________________。
(3)2,5-二甲基-2,4-己二烯 的结构简式:__________________________。
(4)有机物 的系统名称为________________
的系统名称为________________
(5)结构简式  的烃可命名为___________________。
的烃可命名为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,测得溶液的pH随加入盐酸的体积变化如图所示。下列说法正确的是( )
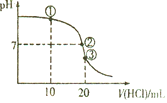
A.①溶液中:c(Cl-)=2c(NH4+)+2c(NH3·H2O)
B.②溶液中:c(NH4+)= c(Cl-)= c(OH-)= c(H+)
C.③溶液中:c(H+)= c(OH-)+ c(NH4+)+c(NH3·H2O)
D.滴定过程中可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com