
����Ŀ����12�֣�
����ij�¶��£�0.1 mol/L����������Һ�д���ƽ�⣺
��H2S(aq)![]() H+(aq)+HS��(aq)����HS��(aq)
H+(aq)+HS��(aq)����HS��(aq)![]() H+(aq)+S2��(aq)��
H+(aq)+S2��(aq)��
��1����������Һ�д��ڵ������� ���������������֣�
��2������H2S��Һ��( )
A����ˮ��ƽ�������ƶ�����Һ��������Ũ������
B��ͨ�����SO2���壬ƽ�������ƶ�����ҺpH����
C���μ�������ˮ��ƽ�������ƶ�����ҺpH��С
D��������������ͭ����(��������仯)����Һ����������Ũ�ȶ���С
����25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.7��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
��ش��������⣺
��1��CH3COOH�ĵ���ƽ�ⳣ������ʽ ��
��2��CH3COOH��H2CO3��HClO��������ǿ������˳��Ϊ ��
��3�����Ϊ10mLpH��2�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ������pH�仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ�� (����ڡ��������ڡ���С�ڡ�)����ĵ���ƽ�ⳣ���������� ��

������25���£���amol��L��1�İ�ˮ��0.01mol��L��1������������ϣ���Ӧƽ��ʱ��Һ��c(NH![]() )��c(Cl��)������Һ�� ��(��ᡱ��������С�)���ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb�� ��
)��c(Cl��)������Һ�� ��(��ᡱ��������С�)���ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb�� ��
���𰸡���12�֣�
������1��H+��HS����S2����OH�� ��2������2��C ��2����
����1��![]() ��2����
��2����
��2��CH3COOH>H2CO3>HClO��1�֣�
��3�����ڣ�ϡ����ͬ������HX��pH�仯��CH3COOH�Ĵ�����ǿ������ƽ�ⳣ������1����
������1������ ![]() ��2����
��2����
��������
���������
������1������H2S�ĵ��뼰ˮ�ĵ��뷽��ʽ������������Һ�д��ڵ�������H+��HS����S2����OH����
��2��A����ˮ�ٽ�H2S�ĵ��룬������Һ�������������Ũ�ȼ�С����A����B����Ӧ��2H2S��SO2===3S����2H2O��ƽ�������ƶ�����SO2������SO2+H2O=H2SO3����Һ�����ԣ���H2SO3���Ա�H2Sǿ����pH��С����B����C���μ�������ˮ��������ӦCl2��H2S===2HCl��S����ƽ�������ƶ���������ǿ�ᣬ��������Դ��������ᣬ��ҺpH��С����C��ȷ��D��������������ͭ���壬������ӦH2S��Cu2��===CuS����2H����H��Ũ������D����� ��ѡC��
����1��CH3COOH�ĵ���ƽ�ⳣ������ʽΪ![]() ��
��
��2�����ݵ���ƽ�ⳣ������������ƽ�ⳣ��Խ������Խǿ����������˳��ΪCH3COOH>H2CO3>HClO��
��3����pH����Һ��ˮϡ����ͬ������HX�仯��˵��������ǿ�ڴ��ᣬ�����ƽ�ⳣ�����ڴ���ĵ���ƽ�ⳣ����
�� 25��ʱ�������Һ�ʴ��ڵ���غ�c(NH4+)+c(H+)=c(OH-)+c(Cl-)����Ϊ����c(NH4+)=c(Cl-)������c(H+)=c(OH-)����Һ������������c(H+)=c(OH-)=10-7 mol/L����Ϻ���Һ�������һ����������Һ��c(Cl-)=0.005mol/L��c(NH4+)=c(Cl-)=0.005mol/L��c(NH3H2O)=0.5amol/L��c(NH4+)=0.5amol/L��0.005mol/L��Kb=![]() =
=![]() mol/L=
mol/L=![]() mol/L���ʴ�Ϊ��
mol/L���ʴ�Ϊ��![]() mol/L��
mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��Ч�������������ػ�����ȡ��ʩ���ƴ�����������Ч���ƿ����е������̼����������������Ե���Ϊ��Ҫ��
(1)�������������ڰ��մ�ת�������ɽ�����β������Ҫ��Ⱦ��ת��Ϊ���Ĵ���ѭ�����ʡ�
��֪����N2(g)��O2(g)��2NO(g) ��H��+180.5kJ��mol-1
��C��CO��ȼ����(��H)�ֱ�Ϊ-393.5kJ��mol-1��-283kJ��mol-1
��2NO(g)��2CO(g)��N2(g)��2CO2(g))��H��_______kJ��mol-1
(2)��0.20molNO��0.10molCO����һ���ݻ�Ϊ1L���ܱ������У���Ӧ����������Ũ�ȱ仯��ͼ��ʾ��
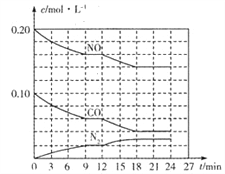
��CO��0-9min�ڵ�ƽ����Ӧ����v(CO)=________mol��L-1��min-1 (������λ��Ч���֣�����12 minʱ�ı�ķ�Ӧ��������Ϊ________��
A.�����¶� B.����NO C.�Ӵ��� D.�����¶�
�ڸ÷�Ӧ�ڵ�18 minʱ�ﵽƽ��״̬��CO2���������Ϊ________��������λ��Ч���֣�����ѧƽ�ⳣ��K=________��������λ��Ч���֣���
(3)ͨ���˹���������ܽ�ˮ��ȼú������CO2ת����HCOOH��O2����֪������0.1mol��L-2��
HCOONa��ҺpH=10����HCOOH�ĵ��볣��Ka=______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������8�����ʣ�����ʹ���Ը��������Һ��ɫ��������ˮ��Ӧʹ֮��ɫ������ ��
�ټ��� �ڱ� �۾���ϩ ��1,3-����ϩ ��2-��Ȳ ���ڶ��ױ� ����ȩ ���ϩ
A. �ۢܢݢ� B. �ܢݢߢ� C. �ܢݢ� D. �ۢܢݢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȥ��һ�������ǻ���ʣ��ṹ��Ϊ������������SO2������Ϊ������������SOCl2��SO2Cl2��COCl2�ֱ��Ϊ�������ȡ������Ⱥ�̼���ȣ����Ƕ��кܶ����Ƶ����ʣ��綼�ܷ���ˮ�ⷴӦ���ɶ�Ӧ���ᡢ�������Ȼ����ȡ��ش��������⣺
��1����֪��SO2(g)+PCl5(s)![]() SOCl2(l)+POCl3(l) ��H1=a kJ��mol1
SOCl2(l)+POCl3(l) ��H1=a kJ��mol1
PCl5(s)+H2O(l)![]() POCl3(l)+2HCl(g) ��H2=b kJ��mol1
POCl3(l)+2HCl(g) ��H2=b kJ��mol1
��ӦSOCl2(l)+H2O(l)![]() SO2(g)+2HCl(g) ��H3=_________ kJ��mol1���ú�a��b�Ĵ���ʽ��ʾ����
SO2(g)+2HCl(g) ��H3=_________ kJ��mol1���ú�a��b�Ĵ���ʽ��ʾ����
��2������1 L���ܱ������г���1 mol SO2��2 mol Cl2��������Ӧ��SO2(g)+Cl2(g)![]() SO2Cl2(l)��
SO2Cl2(l)��
��Ӧ��ƽ��������������䣬��Сѹǿ��������ͼ�л����ı�������Ӧ������ʱ��ı仯����ͼ��

���ٴδ�ƽ�����SO2��ת����Ϊ35%����Ӧ�����ܱ�������ע��������BaCl2��Һ���������ɳ���������Ϊ__________g��
��3��һ�������´��ڷ�Ӧ��CO(g)+Cl2(g)![]() COCl2(g)��H=108 kJ��mol1������3�������Ϊ
COCl2(g)��H=108 kJ��mol1������3�������Ϊ
10 L���ܱ�������������������������ʾͶ�ϣ�����150�������¿�ʼ��Ӧ��ƽ�⡣
�ܱ������������Ⱥ��ݣ���1 mol CO��1 mol Cl2
�ܱ������������º��ݣ���1 mol COCl2
�ܱ������������º��ݣ���1 mol CO��1 mol Cl2
����������CO��ת��������������COCl2��ת����֮��_____________��������������������������1����������Ӧ����ѧƽ�ⳣ��ΪK1���������Ļ�ѧƽ�ⳣ��ΪK2��K1��K2�Ĺ�ϵΪ_____________��
���������з�Ӧǰ��ѹǿΪ1 atm����Ӧ�����ѹǿΪ0.75 atm����Ӧ��ƽ�ⳣ��Kp=_________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����ȷ���� ( )
A��ij�ض���Ӧ��ƽ�ⳣ�������¶ȵĺ���
B����ѧƽ�ⷢ���ƶ���ƽ�ⳣ���ط����仯
C����������һ��ʱ��ƽ�ⳣ�������仯����ѧƽ��ض������ƶ�
D���������ܸı�ƽ�ⳣ���Ĵ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.��ζ�������ˮ
B.������ȷֽⶼ�ܵõ�����
C.��ȥNH4Cl��Һ��������CaCl2 �� �ӹ�����NH4HCO3��Һ�����
D.������Һ���ȶ�������ʹ��ɫʯ���Ա�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ�����ں���ɻ���ʹ�õ������أ��䷴Ӧԭ��ʾ��ͼ��ͼ�������й�����ȼ�ϵ�ص�˵������ȷ����

A������A��B���缫û�л�Բ�𣬲��ܹ���ԭ���
B��A�缫�Ǹ������缫�Ϸ���������Ӧ
C������Ϊ����Ⱦ��ˮ�����ڻ����Ѻõ���ɫ���
D�����·�е�����B�缫ͨ����������A�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ����CO2�е�SO2 �� ��ý��������ͨ������������Һ�У� ��
A.�����ռ���Һ
B.����С�մ���Һ
C.���ʹ�����Һ
D.Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У��������������ȵ��ǣ� ��
A.Na+��Li+ B.CO��CO2 C.H2O ��Al3+ D.NO��CO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com