
| A、N2的结构式::N≡N: |
B、NaCl的电子式: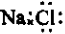 |
| C、Cr的价层电子排布图:3d54s1 |
D、F-的结构示意图: |
 ,故B错误;
,故B错误; ,故D正确;
,故D正确;

科目:高中化学 来源: 题型:
| A、1 mol Na与O2完全反应生成Na2O或Na2O2均失去NA个电子 |
| B、欲配置1.00L,1.00mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| C、标况下,22.4L的C2H5OH与足量金属钠反应可产生0.5NA个氢气分子 |
| D、1.00mol NaCl中,所有的Na+含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A、该硫酸的物质的量浓度为9.2mol?L-1 |
| B、配制250mL4.6mol?L-1的稀硫酸需取该浓硫酸62.5mL |
| C、该硫酸浓度太大,不能用于干燥氨气 |
| D、该硫酸与等质量的水混合后所得溶液的物质的量浓度等于9.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液导电,所以NaCl溶液是电解质 |
| B、Cu能导电,所以Cu是电解质 |
| C、SO3溶于水能导电,所以SO3是电解质 |
| D、液态酒精、酒精的水溶液不导电,所以酒精是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B、温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液 |
| C、AgCl的Ksp=1.8×10-10 mol2?L-2,在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2?L-2 |
| D、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4Cl |
| B、NaOH固体 |
| C、MgCl2固体 |
| D、NaCl固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com