
【题目】将2.80g含氧化镁的镁条完全溶于50.0mL硫酸溶液后,滴加2.00mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去氢氧化钠溶液200.0mL。将所得的沉淀灼烧、冷却后称量得固体质量为4.40g。
已知:Mg(OH)2在灼烧过程中发生如下反应Mg(OH)2![]() MgO+H2O
MgO+H2O
请计算:
(1)用去的氢氧化钠溶液中含溶质的物质的量n(NaOH)=_______mol。(结果保留小数点后两位有效数字)
(2)镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=________。
【答案】0.40 1:10
【解析】
(1)根据n=cV计算NaOH的物质的量;
(2)MgO、Mg的质量和为2.80g,经一系列反应,最后完全转化为MgO后质量为4.40g,可根据质量差得到Mg的质量和物质的量,再根据n=![]() 计算反应物MgO物质的量及二者的比值。
计算反应物MgO物质的量及二者的比值。
(1)反应消耗的NaOH的物质的量为n(NaOH)=cV=2.00mol/L×0.2L=0.40mol;
(2)2.80g含氧化镁的镁条完全溶解在硫酸中得到MgSO4,向该溶液中加入NaOH溶液后MgSO4转化为Mg(OH)2沉淀,将沉淀过滤、洗涤、灼烧发生反应:Mg(OH)2![]() MgO+H2O,冷却后称量得固体MgO质量为4.40g,二者的质量差为Mg转化为MgO时消耗的O的质量m(O)=4.40g-2.80g=1.60g,n(Mg)=n(O)=1.60g÷16g/mol=0.10mol,则在2.80g含有氧化镁的镁条中含有MgO的物质的量为n(MgO)=(2.80g-0.1mol×24g/mol)÷40g/mol=0.01mol,则镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=0.01mol:0.10mol=1:10。
MgO+H2O,冷却后称量得固体MgO质量为4.40g,二者的质量差为Mg转化为MgO时消耗的O的质量m(O)=4.40g-2.80g=1.60g,n(Mg)=n(O)=1.60g÷16g/mol=0.10mol,则在2.80g含有氧化镁的镁条中含有MgO的物质的量为n(MgO)=(2.80g-0.1mol×24g/mol)÷40g/mol=0.01mol,则镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=0.01mol:0.10mol=1:10。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
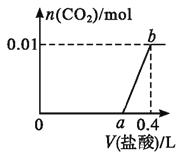
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
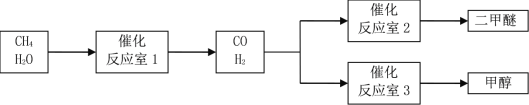
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
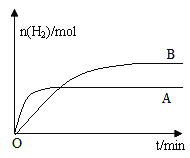
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
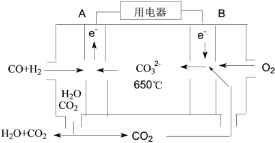
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属在人类生产生活中得到了广泛应用,请你回答下列问题。
(1)面包发酵粉的主要成分之一是一种钠盐,其俗称为________;漂白粉的有效成分为__________(写化学式);FeCl3常用作净水剂,其原理为_________(用离子方程式表示)。
(2)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是_________。
(3)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(4)某CuSO4、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相等(不考虑水解),且SO42-的物质的量浓度为6mol/L,则此溶液中阳离子的浓度为___________mol/L,若向此溶液中加入金属Zn,则最多溶解Zn的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 雕刻玻璃的试剂主要成分的电子式为:![]()
B. 新制氯水中含氧酸的结构式:H—Cl—O
C. S2-的结构示意图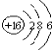
D. 标准状况下密度为1.25g/L的气态烃的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机化学中普遍存在,中学阶段常见的同分异构体有三类。① 官能团异构(类别异构):是指由于官能团的不同而引起的同分异构现象。② 官能团位置异构:是指由于官能团取代的位置不同而引起的同分异构现象。③碳链异构:是指由于碳原子的排列顺序不同而引起的同分异构现象。已知分子式为C5H12O的有机物有很多同分异构体,下面给出其中的四种:
A.CH3—CH2—CH2—CH2—CH2OH B.CH3—O—CH2—CH2—CH2—CH3
![]()
![]()
根据上述信息完成下列各题:
(1) 根据所含官能团判断,A属于________类有机化合物,B物质的官能团名称为____________。B、C、D中,与A互为官能团异构的是________(填代号,下同),互为碳链异构的是________,互为官能团位置异构的是________
(2) 写出与A互为官能团位置异构(但与B、C或D不重复)的有机物的结构简式:_____________
(3) 与A互为碳链异构的同分异构体共有5种,除B、C或D中的一种外,其中两种的结构简式为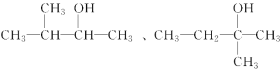 ,写出另外两种同分异构体的结构简式:____________________、_______________________。
,写出另外两种同分异构体的结构简式:____________________、_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。

(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点表示当加入_______ mol NaOH时,Al3+已经______,Mg2+已经___________。
(4)图中线段OA∶AB=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2LN2含有的分子数为0.5NA
B.标准状况下,11.2LH2O含有的分子数为0.5NA
C.在常温常压下,71gCl2所含分子数为NA
D.标准状况下,32gO2中含有的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置(图中夹持仪器略去)测定牙膏样品中碳酸钙的质量分数,下列说法错误的是
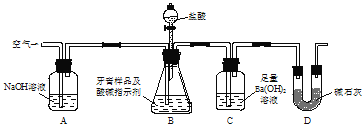
A.实验过程中持续通入空气可起到搅拌B、C中的反应物的作用
B.实验过程中滴加盐酸的速率不宜过快
C.依据装置C在反应前后的质量差测定的结果会偏高
D.C中的沉淀经过滤、干燥、称重后可确定牙膏样品中碳酸钙的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com