
【题目】下列有关元素周期表中“周期”的说法错误的是
A. 元素周期表中有四个长周期、三个短周期
B. 同一周期主族元素原子的核外电子层数相同
C. 同一周期主族元素原子的价电子数目不同
D. 元素周期表中每个周期均从金属元素开始,以非金属元素结束
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 向NaClO和NaCl混合溶液中滴少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:Al3++2SO42-+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为_____________。(2)卤素单质及其化合物在工农业生产和生活中都有重要的用途。
①同主族元素的电负性大小存在一定的规律,卤族元素(F、CI、Br、I)中,电负性最,小的是____,基态Br原子的价电子排布为___________________。
②硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3。BF3分子的分子构型为____,BF3-NH3中BF3与NH3之间通过结合____(填“离子键”、“配位键”或“氢键”)。
(3)某金属是抗癌药物中的明星元素,其晶体中金属原子的堆积方式如右图所示。Mg/mol金属原子的配位数为___________;N已知金属的摩尔质量为Mg/mol,原子半径为rpm,阿伏加德罗常数为NA,则该晶胞的密度为____g/cm3。(用含M、NA、r的代数式表示,lpm=1.0×10—10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CO和CO2的混合气体,在标准状况下的体积为11.2L。请回答下列问题:
(1)该混合气体总的物质的量为_______。
(2)混合气体中碳原子的个数为___________。(用NA表示阿伏加德罗常数的值)
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。
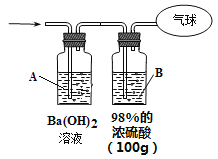
①从A瓶中获得沉淀质量的操作是_____________________称量。
②Ba(OH)2溶液浓度的测定。步骤如下:
a、过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b、将B瓶中的溶液配成1L溶液
c、将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为______________。 原Ba(OH)2溶液的浓度为___________。
③气球中收集到的气体的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl 2 通入水中:Cl 2 +H 2 O == 2H+ +Cl― +ClO―
B. 用氯化铁溶液腐蚀线路板上的铜:Fe 3+ +Cu == Fe 2+ +Cu 2+
C. Al 与 NaOH 溶液反应:2Al+2OH―== 2AlO 2― +H2 ↑
D. 稀硫酸与氢氧化钡溶液混合:2H++SO42―+Ba2+ +2OH― == BaSO4 ↓+2H 2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯硅烷(SiHCl3)在空气中极易燃烧,易与水反应生成两种酸,主要用于生产多晶硅、硅油等,熔点为134 ℃、沸点为31.8 ℃。已知氯化氢气体在加热条件下可与单质硅反应得到三氯硅烷,某同学利用如图装置制备一定量的三氯硅烷(加热装置均省略)。

(1)制备HCl气体的方法之一是将浓硫酸与浓盐酸混合,下列性质与制备原理无关的是______(填字母),B装置的作用是___________________,冰盐水的作用是________________________。
A.浓硫酸具有脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气体的溶解度随温度升高而降低
(2)实验开始后,首先要通入一段时间的HCl气体后才能对C处试剂加热,目的是:①排出装置中空气,防止硅与氧气反应,②_____________________。该套实验装置有两处明显的错误:①E中会产生倒吸,②____________________。E装置的用途是_______________________。
(3)加热条件下,C中发生的是置换反应,相应的化学方程式为________________________。
(4)制得的SiHCl3中含有少量SiCl4(沸点为57.6 ℃),提纯SiHCl3采用的适宜方法为__________,收集SiHCl3时温度应控制在_____________。
(5)设计一个实验证明C中产生的气体是H2:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com