
 ;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.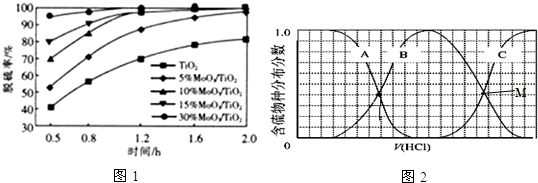
分析 (1)羰基硫分子与二氧化碳分子结构相似,均为直线型;反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3;II中主要反应硫化钠与水反应生成S2O32-、氢气和氢氧化钠,根据电子守恒和原子守恒书写;
(2)A、根据平衡常数仅与温度有关判断;
B、根据图象分析,当反应时间小于0.5h,反应仍然在进行;
C、根据图象分析,以1.6h作垂线,分析负载MoO3的量为10%和15%的脱硫率的纵坐标大小;
D、根据图象分析,0.5~1.2h时内任一点作垂线,依据负载MoO3的量的变化分析纵坐标脱硫速率的变化;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,结合图1所示H2S、HS-、S2-的分布分数进行解答;NaHS的含量先增加后减少;根据物料守恒可求得滴加过程中,溶液中微粒浓度大小关系.
解答 解:(1)羰基硫分子与二氧化碳分子结构相似,均为直线型,其电子式为 ,反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,
,反应I除生成两种正盐外,还有水生成,由元素守恒可知,生成正盐为Na2S、Na2CO3,反应为COS+4NaOH=Na2S+Na2CO3+2H2O,硫化钠与水反应生成S2O32-、氢气和氢氧化钠,其反应的离子方程式为:2S2-+5H2O=S2O32-+4H2↑+2OH-,
故答案为: ,COS+4NaOH=Na2S+Na2CO3+2H2O,2S2-+5H2O=S2O32-+4H2↑+2OH-;
,COS+4NaOH=Na2S+Na2CO3+2H2O,2S2-+5H2O=S2O32-+4H2↑+2OH-;
(2)A、根据平衡常数仅与温度有关,所以负载MoO3的量越大,平衡常数不变,故A错误;
B、根据图象,当反应时间小于0.5h,反应仍然在进行,脱硫率较小,但不等于0,故B错误;
C、根据图象,以1.6h作垂线,负载MoO3的量为10%和15%的脱硫率相等,故C正确;
D、根据图象,0.5~1.2h时内任一点作垂线,负载MoO3的量越大,脱硫速率也越大,故D正确;
故答案为:CD;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,A表示含硫微粒浓度减小为S2-,B先增加后减少为HS-,C浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
故答案为:HS-;3[c(H2S)+c(HS-)+c(S2-)]、c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+).
点评 本题考查了电子式的书写、离子方程式和化学方程式的书写、弱电解质的电离和盐的水解等,明确弱电解质的电离特点、电离平衡常数与酸根离子水解程度的关系再结合守恒思想分析解答,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

 .
. .
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下:
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,选择的萃取剂的密度必须比水大 | |
| D. | 分液操作时,上层液体从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | I2具有还原性 | ||
| C. | 当生成1mol Cl2时转移2mol电子 | D. | 氧化剂是KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com