
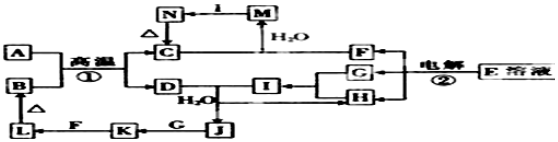
 ;
;分析 L为红褐色沉淀,则L为Fe(OH)3,Fe(OH)3受热分解生成B为Fe2O3,A、D是金属单质,A与B在高温下反应生成D,则该反应为铝热反应,所以A为Al,C为Al2O3,D为Fe,E为食盐的主要成分,则E为NaCl,电解E得F、G、H分别为NaOH、H2、Cl2,G、H反应生成I,I的水溶液呈强酸性,则F为NaOH,所以I为HCl,D和I反应生成H和J,则H为H2,J为FeCl2,所以G为Cl2,J与G反应生成K为FeCl3,C和F反应生成M为NaAlO2,M与I生成N,N受热分解得C,则N为Al(OH)3,据此答题.
解答 解:L为红褐色沉淀,则L为Fe(OH)3,Fe(OH)3受热分解生成B为Fe2O3,A、D是金属单质,A与B在高温下反应生成D,则该反应为铝热反应,所以A为Al,C为Al2O3,D为Fe,E为食盐的主要成分,则E为NaCl,电解E得F、G、H分别为NaOH、H2、Cl2,G、H反应生成I,I的水溶液呈强酸性,则F为NaOH,所以I为HCl,D和I反应生成H和J,则H为H2,J为FeCl2,所以G为Cl2,J与G反应生成K为FeCl3,C和F反应生成M为NaAlO2,M与I生成N,N受热分解得C,则N为Al(OH)3,
(1)HCl为共价化合物,氢原子和氯原子间形成一对共用电子对,电子式为: ,故答案为:
,故答案为: ;
;
(2)反应①为铝热反应,反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(3)向M为NaAlO2溶液中加入过量的I为HCl溶液反应的离子方程式为:AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O;
(4)L为红褐色沉淀,则L为Fe(OH)3,化合反应生成氢氧化铁defy为氢氧化亚铁和氧气、水反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)3+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)3+O2+2H2O=4Fe(OH)3;
(5)常温下,在pH=12的F为NaOH溶液中逐渐滴入pH=2的CH3COOH至pH=7后,c(H+)=c(OH-),溶液中存在电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
所得溶液中离子浓度的大小关系是
故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(6)从K为FeCl3的结晶水合物制备K的无水晶体,需要防止铁离子水解生成氢氧化铁沉淀,所以加热失去结晶水的操作为:在干燥的HCl气流中加热失水,
故答案为:在干燥的HCl气流中加热失水;
(7)在J为FeCl2的溶液中加入酸化H2O2的反应是过氧化氢氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握铝热反应及两性化合物的性质为解答的关键,侧重Al、Fe及其化合物之间转化反应的考查,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液显电中性,胶体带有电荷 | |
| B. | 用渗析的方法“净化”胶体时,使用的半透膜只能让分子通过 | |
| C. | 可用丁达尔效应区分溶液和胶体 | |
| D. | 胶体不稳定,静置后容易产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO3 | B. | NaCl | C. | ClO2 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①②③④ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子的还原性强弱:Iˉ>Fe2+>Clˉ | |
| B. | 当a≥b时,发生的离子反应:2Fe2++Cl2=2Fe3++2Clˉ | |
| C. | 当a=b时,反应后的离子浓度之比:c(Fe2+):c(Clˉ)=1:2 | |
| D. | 当3a≤2b时,发生的离子反应:2Fe2++4Iˉ+3Cl2=2Fe3++2I2+6Clˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①④ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | a | 1.80 |
| 328.2 | 9.00 | 7.50 | 6.00 | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | 318.2K,蔗糖起始浓度为0.400 mol•L-1,10min后蔗糖浓度略大于0.376 mol•L-1 | |
| B. | b K时,若蔗糖的浓度为0.35 mol•L-1,则v=1.26 mmol•L-1•min-1 | |
| C. | b<318.2 | |
| D. | 若同时改变反应温度和蔗糖的浓度,则v肯定变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com