
| A. | -OH与  组成元素相同,含有的电子数也相同 组成元素相同,含有的电子数也相同 | |
| B. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| C. | 丙烷分子的球棍模型示意图: | |
| D. | 乙炔的最简式:CH≡CH |
分析 A.-OH与  分别为羟基和氢氧根离子;
分别为羟基和氢氧根离子;
B.主链应含有6个C原子;
C.丙烷为饱和烷烃,存在碳碳单键和碳氢单键,四个碳原子在一条链上;
D.乙炔中n(C):n(H)=1:1.
解答 解:A.-OH与  分别为羟基和氢氧根离子,二者含有的电子数不同,故A错误;
分别为羟基和氢氧根离子,二者含有的电子数不同,故A错误;
B.主链应含有6个C原子,名称为,2,4-二甲基-4-乙基己烷,故B错误;
C.丙烷为饱和烷烃,存在碳碳单键和碳氢单键,四个碳原子在一条连上,丙烷的球棍模型为: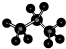 ,故C正确;
,故C正确;
D.乙炔中n(C):n(H)=1:1,最简式为CH,故D错误.
故选C.
点评 本题考查了化学用语的判断,为高考常见题型和高频考点,属于基础知识的考查,题目难度中等,注意掌握常见有机物的表示方法,试题考查了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,产生H2速率减小,H2体积不变 | |
| B. | 加入NH4HSO4固体,产生H2速率不变,H2体积不变 | |
| C. | 加入CH3COONa固体,产生H2速率减小,H2体积减小 | |
| D. | 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.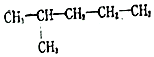 2-甲基戊烷
2-甲基戊烷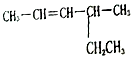 4-甲基-2-己烯.
4-甲基-2-己烯.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水解达到平衡时(不饱和),加氯化铁溶液达饱和,溶液的酸性会增强 | |
| B. | 浓度为5 mol•L-1和0.5 mol•L-1的两种 FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 | |
| C. | 有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小 | |
| D. | 为抑制 Fe3+的水解,较好地保存 FeCl3溶液,应加少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:
乙酸、氰酸、碳酸等都是重要的碳的化合物.己知如下信息:| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | Ka=l.8×l0-5 | Ka=4.9×10-10 | Kal=4.3×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
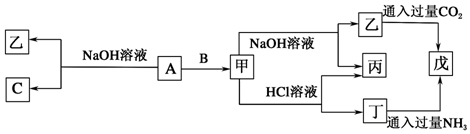
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Ca2+ | C. | I- | D. | SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com