
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
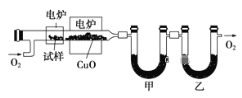
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)
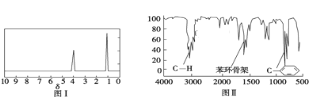
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为___________。
(2)X的分子式为___________;(写出计算过程)X的结构简式为___________;
【答案】质谱法 烃X的物质的量为2.12g÷106g/mol=0.02mol,生成二氧化碳为7.04g÷44g/mol=0.16mol,生成水为1.8g÷18g/mol=0.1mol,则分子中N(C)=0.16mol÷0.02mol=8、N(H)=0.1mol×2÷0.02mol=10,故X的分子式为C8H10 ![]()
【解析】
烃X的物质的量为2.12g÷106g/mol=0.02mol,生成二氧化碳为7.04g÷44g/mol=0.16mol,生成水为1.8g÷18g/mol=0.1mol,则分子中N(C)=0.16mol÷0.02mol=8、N(H)=0.1mol×2÷0.02mol=10,故X的分子式为C8H10,X的红外光谱测定含有苯环,属于苯的同系物,而1H核磁共振谱有2个峰,其面积之比为2:3,则X为![]() 。
。
(1)通过仪器分析得知相对分子质量的方法为质谱法,故答案为:质谱法;
(2)分子中N(C)=0.16mol÷0.02mol=8、N(H)=0.1mol×2÷0.02mol=10,故X的分子式为C8H10,X的红外光谱测定含有苯环,属于苯的同系物,而1H核磁共振谱有2个峰,其面积之比为2:3,则X为![]() 。故答案为:C8H10 ,
。故答案为:C8H10 , ![]() 。
。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2B.COC.C8H18D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI 与Cu(NO3)2 的反应,进行实验一:

注: 本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验: 向2mL Imol/LKI 溶液中加入1mL______溶液( 硝酸酸化,pH=1.5 ),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论: 实验一中生成I2 的原因是酸性条件下,NO3- 氧化了I-。
②乙同学认为仅由甲同学的实验还不能得出相应结论。他的理由是该实验没有排除____氧化I-的可能性。
③若要确证实验一中是NO3-氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知: CuI 为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2; b.______吸附I2。
为证明上述假设是否成立,取棕黑色沉淀进行实验二:

已知: CuI难溶于CCl4;I2+2S2O32-=2I-+S4O62-(无色);Cu++2S2O32-=Cu(S2O3)23-(无色)。
由实验二得出结论: 棕黑色沉淀是CuI吸附I2 形成的。
②现象ⅲ为______________。
③用化学平衡移动原理解释产生现象ii 的原因:________________。
④由实验二可推知,Cu(NO3)2 与KI 反应过程中,一定发生的反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
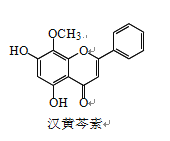
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
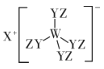
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是

A.图①可以表示某化学平衡体系改变温度后,反应速率随时间的变化
B.图②中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0未使用和使用催化剂时,反应过程中的能量变化
C.图③表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且甲的压强大
3C(g)+D(g)的影响,且甲的压强大
D.图④中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0逆反应的平衡常数K随温度的变化
2SO3(g)△H<0逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是 ,其值是 。
(N2)中最大的是 ,其值是 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是 (填“正反应方向”或“逆反应方向”),采取的措施是 。
(4)第Ⅰ阶段时,化学平衡常数K1= ;第Ⅱ、Ⅲ阶段化学平衡常数K2 K3;(填“>、<、=”)判断的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com