
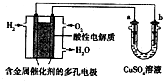
| A. | 燃料电池工作时,正极反应为:O2+4H++4e-═2H2O | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是纯铜,b极是粗铜时,可以达到铜的精炼目的 | |
| D. | a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
分析 左边装置是氢氧燃料电池,所以是原电池,原电池放电时,燃料失电子发生氧化反应,所以投放燃料的电极为负极,投放氧化剂的电极为正极,正极上氧化剂得电子发生还原反应,由于电解质溶液呈酸性,正极反应为:O2+4e-+4H+=2H2O;右边装置有外接电源,所以是电解池,连接负极的b电极是阴极,连接正极的a电极是阳极,阳极上失电子发生氧化反应,阴极上得电子发生还原反应,结合电解反应解答.
解答 解:A.因该燃料电池是在酸性电解质中工作,所以正极反应为:O2+4e-+4H+=2H2O,故A正确;
B.a与电池正极相连,a为电解池阳极,b与电池的负极相连,b为电解池阴极,所以应该是a极的Cu溶解,b极上析出Cu,故B错误;
C.a极是粗铜,b极是纯铜时,为粗铜的精炼,电解时,a极逐渐溶解,b极上有铜析出,不符合精炼铜原理,故C错误;
D.电解CuSO4溶液时,a极产生的气体为O2,产生1molO2需4mol电子,所以需要燃料电池的2molH2,二者的体积并不相等,故D错误;
故选A.
点评 本题考查原电池和电解池知识,题目难度中等,易错点为B,注意电解质的酸碱性,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和NaOH溶液反应,生成 l mol水时放热57.3 kJ | |
| B. | 含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ | |
| C. | 1L 0.l mol/L CH3COOH与1L 0.l mol/L NaOH溶液反应后放热为5.73 kJ | |
| D. | 1L 0.l mol/L HNO3与 1L 0.l mol/L NaOH溶液反应后放热为 5.73 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
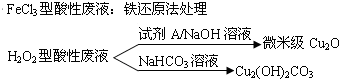
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 杂质方法 | 除杂方法 | 原理 |
| A | 苯中含苯酚杂质 | 加入浓溴水,过滤 | 苯酚能与溴水反应生成白色沉淀 |
| B | 乙酸乙酯中含乙酸杂质 | 加饱和Na2CO3溶液洗涤,分液 | 乙酸乙酯在饱和Na2CO3溶液中的溶解度小且乙酸与Na2CO3反应 |
| C | 除去溴苯中的苯 | 蒸馏 | 苯的沸点比溴苯高 |
| D | 乙醇中含乙酸杂质 | 加入饱和Na2CO3溶液洗涤,分液 | 乙酸能与Na2CO3反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
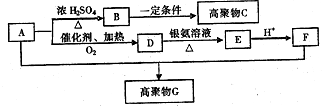 有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化:
有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化: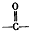 ,则H的结构简式可能为CH3CH2CHO、
,则H的结构简式可能为CH3CH2CHO、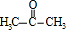 .
.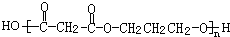 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
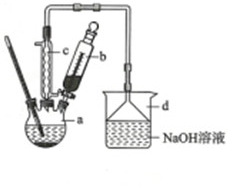
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com