
����Ŀ���ʰ������������[(NH2CH2COO)2Fe]��һ�����͵���Ӫ��ǿ�������㷺����ȱ����ƶѪ��Ԥ�������ơ�ijѧϰС��ģ����ϳɷ������£�

��֪��
�ʰ���(NH2CH2COOH ) | �쿹��Ѫ�� | �ʰ������� | FeSO4.7H2O | FeCl2.4H2O |
������ˮ | ������ˮ���Ҵ� | ������ˮ | ������ˮ | ������ˮ |
�����Ҵ� | �������Ժ�ǿ������ | �������Ҵ� | �������Ҵ� | �������Ҵ� |

��ش�
(1)�ϳ�װ��������b��������____________
(2)�ϳɹ����У�Ϊ�˷�ֹ��������������ʵ���в�ȡ�Ĵ�ʩ��____________
(3)����˵����ȷ����____________
A.����Һ��ǰ��Ӧ�ȴ�Һ©��a���Ͽڲ�����
B.���������Ϣ��������Ӧѡ��FeSO4��7H2O
C.�����������й�Һ���룬�ɲ��ó�ѹ���ˣ�Ҳ�ɲ��ü�ѹ����
D.�ֲ�Ʒ�ᴿ����Ϊ�ؽᾧ�����ˣ�ϴ�ӣ�������и���������ѡ����ո���
(4)�ϳɹ��������pH��5.5��pH���ͻ���߶���ʹ�����½�����˵������_________________
(5)����������ˮ�Ҵ���Ŀ����___________________________________________________
(6)��Ʒ���ȿ��������϶��������ⶨ���ⶨ���̷�Ϊ�����IJ���
I�����л���ת��Ϊ����� II�������ת��Ϊ��������
III�����Լ����հ��� IV���ζ�
������װ�ÿ������II��III��������
�ڽ����в���������˳�����룺

������ϴ����g�м������ռ���Ȼ��I����õ����������dע��e����_________������_________������_________������_________����ʹˮ��������e�������Ӻ�f�¶�����Һ�沢����������ˮϴ����ϴ�ܿڣ�ֹͣ����c ����ȥ��ƿ�������ñ�������Һ���еζ���
A.��k1 B.�ر�k3��k2 C.����c D.��dע������������Һ������ˮ��ϴ����������Һ����ˮ��
�ڹ��ڵζ���������˵����ȷ����____________
A.�ζ��ܱ��뾭��©��ϴ�ӡ���ϴ�����ʹ��
B.��������Һװ��ζ��ܺ����¶������ݣ��ɽ���Ƥ����������������ѹ�����飬���ݿɱ���ˮ����
C.�ζ��տ�ʼʱ�����ֿ����뿪����������Һ��Ȼ����
D.��Ϊ���ⶨ������Ϊ���ܺ�ȷ���������̷������ʲ�Ʒ���Ȳⶨһ�ξͿ�
���𰸡�������ƿ ͨ�뵪���������쿹��Ѫ�� CD pH����H+����NH2CH2COOH�еİ�����Ӧ��pH�������ɳ��� ���ٸʰ���������ˮ�е��ܽ⣬��ʹ��ᾧ��������ȥ���ʣ���߲��ʺʹ��� D B A C A
��������
����װ��ͼ�ش����������ƣ�����ʵ��ԭ���л�ѧ��Ӧ���漰�����ʷ��������ʵ����ã����������Ϣ�����ʵ��������ʼ�ʵ����������ʷ�����ᴿ��ԭ������ѡ����ʵķ�Ӧ����ݵζ�ԭ����ʵ��װ��ͼ����ʵ�鲽�輰����ע�����
(1)����װ��ͼ֪����b��������������ƿ���ʴ�Ϊ��������ƿ��
(2)������ͼ�ͺϳ�װ��ͼ����֪���ϳɹ����У�ͨ���˵��������������ʱȽ��ȶ������μӷ�Ӧ��Ŀ���Ǹ��߿����е���������ֹ�������������ʴ�Ϊ��ͨ�뵪���������쿹��Ѫ�
(3) A.Ϊ�˷�ֹ������Ӵ�����Һ©��a���Ͽڲ��������ܴ�ֱ�Ӵ��¿ڲ������Ϳ��Եμӣ���A����
B.���������Ϣ��FeSO4��7H2O�������Ҵ��������Ҵ�ϴȥ������Ӧ��ѡ���������Ҵ��� FeCl2.4H2O����B����
C.������������������ͨ�����˵ķ������������ʰ����������ɲ��ó�ѹ���ˣ���Ϊ����������Ƚϴ�Ҳ�ɲ��ü�ѹ���ˣ���C��ȷ��
D.�ֲ�Ʒ�ᴿ����Ϊ�ؽᾧ�����ˣ�ϴ�ӣ�������и������Ϊ�˷�ֹ�����������ѡ����ո����D��ȷ���ʴ�Ϊ��CD��
(4) NH2CH2COOH�еİ������м��ԣ�pH����H+����NH2CH2COOH�еİ�����Ӧ��pH��������Fe(OH)2�������ʴ�Ϊ��pH����H+����NH2CH2COOH�еİ�����Ӧ��pH�������ɳ�����
(5)�����Ϣ֪����Ʒ�ʰ��������������Ҵ�����Ӧ��FeCl2.4H2O�������Ҵ������Բ���������ˮ�Ҵ����Լ��ٸʰ���������ˮ�е��ܽ⣬��ʹ��ᾧ������ͬʱ�ܽ���δ��ӦFeCl2.4H2O����߲��ʺʹ��ȣ��ʴ�Ϊ�����ٸʰ���������ˮ�е��ܽ⣬��ʹ��ᾧ��������ȥ���ʣ���߲��ʺʹ��ȣ�
(6)����ο�����Ӧ���ɰ��������ɵİ�����ˮ��������������f�������γɰ�ˮ����g����������Ϊ����dע����Σ�Ȼ����ע������������Һ��������ˮ��ϴ���ر�k3��k2���γ��ܱտռ䣬��ֹˮ�����������k1������c��ʹ������ˮ��������e���ʴ�Ϊ��D��B��A��C��
��A. ���ݵζ�ԭ������֪���ζ��ܱ��뾭��©��ϴ�ӡ���ϴ�����ʹ�ã���A��ȷ��
B. ��������ҺӦ��װ����ʽ�ζ��ܣ���ʽ�ζ����¶��Dz��������������¶������ݣ�����ͨ��������������ˮ���������ݣ���B����
C.�ڵζ������У���ʼ�ղ������뿪���������ƺõζ��ٶȣ���C����
D.�ζ��������ײ���������������Ҫ��βⶨ����D���ʴ�Ϊ��A��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������أ�KBe2BO3F2���Ǽ������ĺ��IJ��ϣ��ҹ���ѧ���ڴ�������о��������������ǰ�С��ش��������⣺
(1)����������зǽ���Ԫ��ԭ�ӵĵ縺�Դ�С˳����______________����̬K+�ĵ����Ų�ʽΪ__________________��
(2)NaBH4���л��ϳ��г��õĻ�ԭ�������е������ӿռ乹����_______________������ԭ�ӵ��ӻ���ʽΪ__________��NaBH4�д���__________�����ţ���
a.���Ӽ� b.��� c.���� d.����
(3)BeCl2�еĻ�ѧ���������ԵĹ����ԣ�����״̬����˫�۷��Ӵ��ڵ�BeCl2�ĽṹʽΪ_________________��
��4����������Ԫ�ط�������۵����±���
������ | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
�۵�/�� | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
���ͱ��з������۵�仯��ԭ��__________________________��
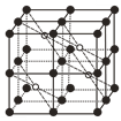
(5)CaF2��һ�־�����ͼ��ʾ��Ca2+ռ��F-�γɵĿ�϶����r(F-)=x pm��r(Ca2+)=y pm���谢���ӵ�������ֵΪNA����CaF2���ܶ���=____________________g��cm-3���г��������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��Һ�����п��ܺ���Fe3+��Al3+��Fe2+��Mg2+��Cu2+��NH4����K+��CO32����SO42����Br�� �����ӵļ��֣�Ϊ������ɷ֣�ȡ����Һ�ֱ�������ĸ�ʵ�飬��������й�������ͼ��ʾ��

���������ͼ�ƶϣ�
��1��ʵ��١�����ȷ��ԭ��Һ��һ������________��_______(�����ӷ��ţ���
��2��ʵ��������������������ԭ�����ӷ���ʽΪ__________________________________��
��3��ʵ����в����Ĵ̼�����ζ�����壬���˳����ø����ʵ�Ũ��Һ��������ܵ��Ƿ�©������Ӧ�Ļ�ѧ����ʽ��_______________________________________________
��4��д��ʵ����У���A��B��������������Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ�������������ӣ�K��L��M��������ЩԪ����ɵ�������ס��ҷֱ���Ԫ��Y��W�ĵ��ʣ����dz����Ĺ��壬���dz��������塣K�Ǻ���ɫ���壬����Ũ��Һ����ǿ�����ԣ��������ʵ�ת����ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��

A.Y��Z��W����Ԫ�ص縺�ԣ�W>Z>Y
B.Y��Z��W����Ԫ�ص�һ�����ܣ�Z>W>Y
C.L�ķе�һ����X��Y��ɵĻ�����е��
D.��X��Y��Z��W���ɵĻ�������ֻ�ܺ��й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹż��еļ���˵������ȷ����
A. �����ݸ�Ŀ�����վ�����Ŀ��д����Ԫʱʼ���䷨����Ũ�ƺ�����굣���������������ˮ��ζ��Ũ�ң��Ǿ�¶Ҳ�����������õ���������ָ����
B. �����ϴ���������ࡷ������(��ͭ)�����ᣬ����������� �����˺Ͻ�Ӳ�ȷ��������
C. �����ݾ���ע���й��ڼ�����ʯ(KNO3)������(Na2SO4)�ļ��أ����Ի���֮����������������ʯҲ�����÷���Ӧ������ɫ��Ӧ
D. ������������ƪ���м��أ�����ɰ(HgS)��֮��ˮ���������ֳɵ�ɰ�����ù��̷����˷ֽ⡢���ϡ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к����dz��ḻ��Ԫ�أ����������ڸ�¯��ұ���ģ���ұ��ҵ�У����ý�̿��ұ������
��1��д����̿�ڸ�¯�����μӵ�������Ӧ�Ļ�ѧ����ʽ�� ________________��
��2��д��������![]() ��ԭ�����Ļ�ѧ����ʽ��__________________________��
��ԭ�����Ļ�ѧ����ʽ��__________________________��
��3��ʵ�����п���![]() ��ԭ
��ԭ![]() ���ڼ���
���ڼ���![]() ǰӦ��_________��������ܷ���________����δ��Ӧ���
ǰӦ��_________��������ܷ���________����δ��Ӧ���![]() ___________����ܡ����ܡ����ŷŵ������У�Ӧ��________������
___________����ܡ����ܡ����ŷŵ������У�Ӧ��________������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о����ְ�����Ϣ���У�![]() (2��4-����-1-��ϩ)��
(2��4-����-1-��ϩ)��![]() (3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
(3��7-����-1-��ϩ)���Ҳϵ�����Ϣ��Ϊ��CH3(CH2)8CH==CH��CH==CH(CH2)8CH3������˵������ȷ����
A��2��4-����1��ϩ�ķ���ʽΪC9H18
B��2��4-����-1-��ϩ��3��7-����-1-��ϩ��Ϊͬϵ��
C������������Ϣ�ؾ���ʹ������Ȼ�̼��Һ��ɫ
D��1 mol�Ҳϵ�����Ϣ����1 mol Br2�ӳɣ�����ֻ��һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ�װ�õ�˵������ʵ��Ҫ����ǣ� ��
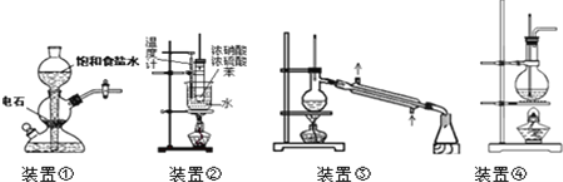
A.װ�â٣�ʵ�����������Ʊ��϶�������Ȳ���ô�װ��
B.װ�âڣ�ʵ�����п��ô�װ�����Ʊ��������������������NO2���Ի�ɫ
C.װ�âۣ�ʵ������ֱ������ҽ�þƾ��Ʊ���ˮ�ƾ�
D.װ�âܣ�ʵ�����п��ô�װ�����Ʊ���������������ƿ�л�ò���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ��Ӧԭ���о���������������������������Ҫ�����塣
��1����֪��2SO2(g)+ O2(g)![]() 2SO3(g) ��H1
2SO3(g) ��H1
2NO(g)+ O2(g)![]() 2NO2 (g) ��H2
2NO2 (g) ��H2
NO2 (g) + SO2(g)![]() SO3(g) + NO(g) ��H3
SO3(g) + NO(g) ��H3
����H3 =__________(����H1����H2��ʾ)���������������Ӧ����ʽ��ƽ�ⳣ���ֱ�ΪK1�� K2��K3����K3 =__________(��K1��K2��ʾ)��
��2����ͼ��ʾ��A �Ǻ��ݵ��ܱ�������B ��һ������ɱ�ij������ҡ����ֺ��£��ر�K2���ֱ�2mol NO ��1 mol O2ͨ��K1��K3�ֱ����A��B �У������ķ�ӦΪ2NO(g)+ O2(g)![]() 2NO2 (g) [������2NO2 (g)
2NO2 (g) [������2NO2 (g)![]() N2 O4 (g) ]����ʼʱA��B �������ͬ��Ϊa L��
N2 O4 (g) ]����ʼʱA��B �������ͬ��Ϊa L��
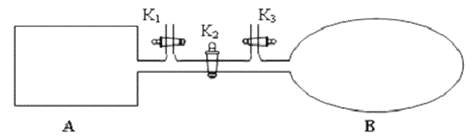
������˵����ʾ��ͼ��ȷ���Ҽ���˵��A �����з�Ӧ�ﵽƽ��״̬������˵��B �����з�Ӧ�ﵽƽ��״̬����_________��
a. A��B �������������ɫ�����ٷ����仯
b. A��B ������NO ��O2���ʵ���Ũ�ȱȾ�Ϊ2:1

�� T��ʱ��A �����з�Ӧ�ﵽƽ��ʱ��ƽ�ⳣ��Kp = 8��10��2 ��kPa)��1����A �����з�Ӧ�ﵽƽ��ʱp(NO2) = 200kPa����ƽ��ʱNO��ת����Ϊ_____________����Kp ����ƽ���ѹ����ƽ��Ũ�ȼ�������ƽ�ⳣ������ѹ����ѹ�����ʵ���������
��3����0.2 mol SO2��0.15 mol O2ͨ��2L ���ܱ������У����SO2�����ʵ�����ʱ��仯�� ͼʵ�� ��ʾ��
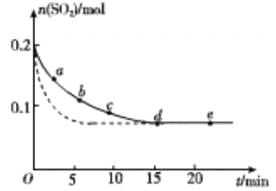
��� | a | b | c | d | e |
n(SO2)/mol | 0.16 | 0.12 | 0.09 | 0.07 | 0.07 |
t/min | 2 | 5 | 8 | 15 | 22 |
��ab ��ƽ����Ӧ����____________��������������С����������������bc ��ƽ����Ӧ���ʣ�de ��ƽ����Ӧ����Ϊ_________________��
�����ı�ijһ��ʵ�����������SO2�����ʵ�����ʱ��仯��ͼ��������ʾ����ı��������__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com