
| A. | 氨水能导电,说明氨气是电解质 | |
| B. | 新制的氯水中存在3 种分子,4 种离子 | |
| C. | 双氧水被称为“绿色氧化剂”其还原产物为O2 | |
| D. | 王水是浓盐酸和浓硝酸按体积比1:3 配成 |
分析 A.氨气为非电解质;
B.氯水中含有氯气、水、次氯酸、氢离子、氢氧根离子、氯离子、次氯酸根离子等微粒;
C.双氧水中O元素化合价为-1价,被氧化生成氧气;
D.王水中浓盐酸和浓硝酸的体积比3:1.
解答 解:A.氨水中存在一水合氨,可电离出铵根离子和氢氧根离子,能导电,但氨气本身不能电离出自由移动的离子,为非电解质,故A错误;
B.氯水中含有氯气、水、次氯酸、氢离子、氢氧根离子、氯离子、次氯酸根离子等微粒,则含有3种分子、4种离子,故B正确;
C.因氧化剂在反应中元素的化合价降低,则双氧水的还原产物为H2O,氧气为氧化产物,故C错误;
D.王水中浓盐酸和浓硝酸的体积比3:1,王水为混合物,能溶解Au、Pt,故D错误.
故选B.
点评 本题考查物质的性质及物质的成分,明确氨水、氯水、王水的组成及氧化剂在反应中元素的化合价变化是解答本题的关键,难度不大.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3
已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
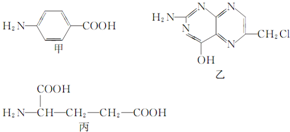 叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.
叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.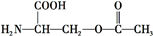 .
.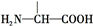
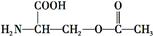 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 | |
| C. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| D. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3)的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、Cl-、NO3-、K+ | |
| B. | 滴入酚酞显红色的溶液中:Na+、Al3+、CO32-、AlO2- | |
| C. | 加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- | |
| D. | 0.1mol•L-1 NaHCO3溶液中:Na+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
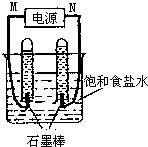 利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.
利用反应CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置及现象如图所示.则①M应是电源的负极(填“正”或“负”);②该电解反应的化学方程式是2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,电解后将溶液混合均匀,此时溶液的pH为11.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com