
| A. | 澄清透明溶液中可能大量存在:Cu2+、Mg2+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液中可能大量存在:K+、NH4+、Cl-、I- | |
| C. | 加入A1能放出大人量H2的溶液中可能大量存在:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液中可能大量存在:K+、AlO2-、CO32-、Na+ |
分析 A.四种离子之间不反应,为澄清透明溶液;
B.该溶液中存在铁离子,铁离子能够氧化碘离子;
C.该溶液呈酸性或强碱性,铵根离子、亚铁离子与氢氧根离子反应,酸性条件下硝酸根离子能够氧化亚铁离子;
D.该溶液中存在大量氢离子,偏铝酸根离子、碳酸根离子都与氢离子反应.
解答 解:A.Cu2+、Mg2+、NO3-、SO42-之间不发生反应,为除去透明溶液,在溶液中能够大量共存,故A正确;
B.加入KSCN显红色的溶液中存在铁离子铁离子,铁离子具有氧化性,能够氧化I-,在溶液中不能大量共存,故B错误;
C.加入Al能放出大人量H2的溶液中存在大量氢离子或氢氧根离子,NH4+、Fe2+与氢氧根离子反应,NO3-、Fe2+在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.常温下,$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×l0-12的溶液呈酸性,溶液中存在大量氢离子,AlO2-、CO32-都与氢离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中都有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 取两小块铝箔,将其中一片打磨,灼烧均能看到铝箔熔化但不滴落的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL0.1mol•L-1的Al2(SO4)3溶液中,含Al3+0.1NA | |
| B. | 36g重氧(18O2)气体所含分子数为NA,占体积为22.4L | |
| C. | 7.8gNa2O2与足量CO2反应,转移电子数为0.1NA | |
| D. | 15g甲基中含有的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
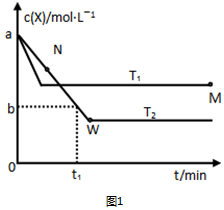

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
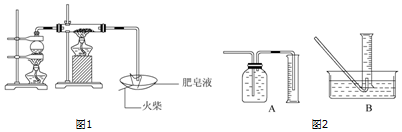
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “神州11号”用Na2O2作氧气的来源,是因为Na2O2能氧化CO2和水产生O2 | |
| B. | FeCl3溶液可用于铜质印刷线路板制作,是因为FeCl3能与铜单质发生置换反应 | |
| C. | Al2O3作耐火材料是因为氧化铝熔点高 | |
| D. | 氨常用作制冷剂利用了氨的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
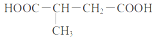
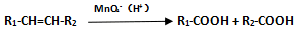
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 不移动 | |
| D. | 可能向正反应方向移动,也可能向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com