
����Ŀ���������������ᣬ�䱾����NO3���������ԣ�ij����ʵ��С������������й�NO3�������Ե�̽����ʵ�����ͨ�������ɣ���
ʵ��װ�� | ��� | ��ҺX | ʵ������ |
| ʵ��� | 6molL��1ϡ���� | ������ָ������ƫת��ͭƬ���������ɫ���壬��Һ���Ϸ���Ϊ����ɫ�� |
ʵ��� | 15molL��1Ũ���� | ������ָ��������ƫת���ܿ���ƫ����ߣ���Ƭ��ͭƬ�����������ɫ���壬��Һ��Ϊ��ɫ�� |
��1��ʵ����У���Ƭ�������������������Һ���Ϸ���������ɫ����Ļ�ѧ����ʽ�� ��
��2��ʵ����е�����ָ����ƫ���ұߺ�ƫ����ߵ�ԭ���� ��
�������ϣ����ý�����1molL��1ϡ���ᷴӦ��H2��NH4+���ɣ�NH4+���ɵ�ԭ���Dz���H2�Ĺ�����NO3������ԭ��
��3������ͼװ�ý���ʵ�����ҺXΪ1molL��1ϡ������Һ���۲쵽������ָ������ƫת��
�ٷ�Ӧ�����Һ�к�NH4+ �� ʵ���Ҽ���NH4+�ķ����� ��
������NH4+�ĵ缫��Ӧʽ�� ��
��4����һ��̽������������NO3���������ԣ�����ʵ����� 
�ٹ۲쵽A����NH3���ɣ�B������������A��B������ͬ����Ľ����� ��
��A������NH3�����ӷ���ʽ�� ��
��5�������ۼ��뵽NaNO3��Һ�������������ʵ���͢�˵������ ��
���𰸡�
��1������2NO+O2=2NO2
��2��Al��ʼ����صĸ�����Al��Ũ������Ѹ��������������Ĥ��Cu������
��3��ȡ����������Һ���Թ��У�����ŨNaOH��Һ�����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����Һ�к�NH4+��NO3��+8e��+10H+=NH4++3H2O
��4��Al��NaOH��Һ��Ӧ����H2�Ĺ����пɽ�NO3����ԭΪNH3 �� ��Mg������NaOH��8Al+3NO3��+5OH��+2H2O=3NH3��+8AlO2��
��5����Ϊ�������Ե���������Һ������H2�Ĺ��̣�NO3��������ԭ
���������⣺��1.������ʵ�������֪��ʵ��1������ָ������ƫת��ͭƬ���������ɫ���壬��Һ���Ϸ���Ϊ����ɫ��˵����ԭ�������������������������Ӧ��ͭ�����������ᱻ��ԭ��һ���������ڿ����б������ɶ�����������Ӧ����ʽΪ2NO+O2=2NO2 �� ���Դ��ǣ�����2NO+O2=2NO2��
��2.��ʵ��2�е�����ָ��������ƫת���ܿ���ƫ����ߣ���Ƭ��ͭƬ�����������ɫ���壬��Һ��Ϊ��ɫ��˵����ʼ���Ǹ�����ͬʵ��1��ͭ�����ж��������������ܿ�����Ũ����ۻ���ͭ������������������Ӧ����������ͭ����Һ����ɫ��������ԭ�ɶ��������������缫���������Դ��ǣ�Al��ʼ����صĸ�����Al��Ũ������Ѹ��������������Ĥ��Cu��������
��3.����ҺXΪ1molL��1ϡ������Һ����Ӧ�����Һ�к�NH4+ �� ˵�����ᱻ��ԭ����笠����ӣ�ԭ���������������ͭ��������������������ԭ��笠����ӣ���ʵ���Ҽ���NH4+�ķ����� ȡ����������Һ���Թ��У�����ŨNaOH��Һ�����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����Һ�к�NH4+ �� ���Դ��ǣ�ȡ����������Һ���Թ��У�����ŨNaOH��Һ�����ȣ�������ʹʪ��ĺ�ɫʯ����ֽ���������壬����Һ�к�NH4+��������NH4+�ĵ缫��Ӧʽ��NO3��+8e��+10 H+=NH4++3H2O�����Դ��ǣ�NO3��+8e��+10 H+=NH4++3H2O��
��4.���ټ���������������Ӧ���������������л�ԭ�ԣ����Խ��������ԭ���ɰ��������ݵ���غ��Ԫ���غ��д�����ӷ���ʽ����þ���û�з�Ӧ�����Դ��ǣ�Al��NaOH��Һ��Ӧ����H2�Ĺ����пɽ�NO3����ԭΪNH3 �� ��Mg������NaOH���ڼ��������������������ԭ���ɰ�������Ӧ�����ӷ���ʽΪ8Al+3NO3��+5OH��+2H2O=3NH3��+8AlO2�� �� ���Դ��ǣ�8Al+3NO3��+5OH��+2H2O=3NH3��+8AlO2����
��5.��������������Һ�в�����������Ҳ�Ͳ��������Ʒ�Ӧ������������ �������Դ��ǣ���Ϊ�������Ե���������Һ������H2�Ĺ��̣�NO3��������ԭ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ͼ��ʾװ����ȡ�廯������D��d�о�ʢ��Һ�壬EΪ����¯˿�Ĵɹܣ�e����ֻ���µĴ������й�ʢ��56gϸ���ۣ�ʵ�鿪ʼʱ�Ƚ����������CO2����ͨ��D�У�Ȼ�����ۼ�����600�桫700�棬E���з�Ӧ��ʼ��E�еķ�ӦΪ��
2Fe+3Br2�T2FeBr3 �� 2FeBr3 ![]() 2FeBr2+Br2����
2FeBr2+Br2����
���d��Һ�����100�桫120���D�У�������Сʱ��������Ӧ�������ܵ�һ�˳����л���ɫ��Ƭ״�廯����80g��
��ش�
��1������d������ ��
��2�������CO2���������E�з�������Ӧ���京��������Ϊ�������ò����к��˸�����û�ѧ�������飮���з����������� ��
A��ȡ�����������Թ��м���ϡ���ᣬ�ټ���KSCN��Һ
B��ȡ����������Ӳ�ʴ��Թ��У�ͨ���������ž���������ȣ���CuSO4�������ɵ�ˮ����
C���ô����������������ܷ�����
D��ȡ�����������Թ��м�������ˮ�����˿��Ƿ��к�ɫ������
��3��Ϊ��ֹ��Ⱦ������ʵ��ʱӦ��F������ʢ��NaOH��Һ��β������װ�ã���Ӧ�Ļ�ѧ����ʽ�� ��
��4��ȡ��Ʒ10g���Ƴ�250mL��Һ��ȡ��25.00mL������KMnO4��Һ�ζ���Һ�е�Fe2+ �� ��ȥ0.03000mol/L����KMnO4��Һ25.00mL�����Ʒ�Ĵ���Ϊ ��
��5�����ó�ȥ���ʺ��FeBr2������֤Cl2��Fe3+��Br2��������ǿ����������Ƶ�ʵ�������Ԥ�Ƶ�ʵ�������ʵ����ۣ�������ǿ������д�����б��ո��ڣ�
ʵ����� | ʵ������ | ������ǿ�� |
�� | ��Һ��Ѫ��ɫ | �� |
�� | �� | Cl2��Br2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)
A. Ħ���DZ�ʾ���ʵ����ĵ�λ,ÿĦ�����ʺ���6.02��1023������
B. 2H�ȿɱ�ʾ2����ԭ��,�ֿɱ�ʾ2 mol��ԭ��
C. ��ͬ���ʵ�����CO��CO2������ԭ������Ŀ֮��Ϊ2��3
D. ��ͬ������CO��CO2������ԭ������Ŀ֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦΪH+(aq)+OH(aq)![]() H2O(l) ��H=57.3 kJ/mol��ϡ���ᡢŨ���ᡢϡ����ֱ���0.1 mol��L1��NaOH��Һǡ����ȫ��Ӧ���ų�������������NaOH��Һ�����֮��Ĺ�ϵ��ͼ��ʾ(CH3COOH����Ҫ����)��������������ȷ����
H2O(l) ��H=57.3 kJ/mol��ϡ���ᡢŨ���ᡢϡ����ֱ���0.1 mol��L1��NaOH��Һǡ����ȫ��Ӧ���ų�������������NaOH��Һ�����֮��Ĺ�ϵ��ͼ��ʾ(CH3COOH����Ҫ����)��������������ȷ����
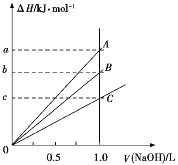
A��A��ʾϡ������NaOH��Һ�ķ�Ӧ
B��B��ʾϡ������NaOH��Һ�ķ�Ӧ
C��b=5.73
D��C��ʾŨ������NaOH��Һ�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֲ������������������ǣ� ��
A.��������B.����̼̼˫��
C.��ˮ��D.�ڼ�ͼ�������������ȫˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ������ ��
A���������������������ֱ���ȫȼ�գ����߷ų�������
B����C(ʯī)��C(���ʯ) ��H = +1.9 kJ��mol��1��֪ʯī�Ƚ��ʯ�ȶ�
C����ϡ��Һ�У�H++OH�� ![]() H2O ��H =��57.3 kJ��mol��1��������1mol CH3COOH�Ĵ�����Һ�뺬1 mol NaOH����Һ��ϣ��ų�������С��57.3 kJ
H2O ��H =��57.3 kJ��mol��1��������1mol CH3COOH�Ĵ�����Һ�뺬1 mol NaOH����Һ��ϣ��ų�������С��57.3 kJ
D�����Ȼ�ѧ����ʽ�������Ƿ�Ӧ�ﻹ���������������ۼ�״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1��1 mol C2H4(g)������O2(g)��Ӧ����CO2(g)��H2O(l)���ų�1411 kJ������ ��
��2��1 mol C2H5OH(l)������O2(g)��Ӧ����CO2(g)��H2O(l)���ų�1366.8 kJ������ ��
��3��2 mol Al(s)������O2(g)������Ӧ����Al2O3(s)���ų�1669.8 kJ������ ��
��4����200��C��101 kPaʱ��1 mol H2���������������HI���壬�ų�14.9 kJ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȼҵ��ȼ�ϵ�������ܹ���Ч������Դ���ģ���ͼ�Ǹù��յ�ͼʾ����Դ���缫δ���������ش��������⣺ 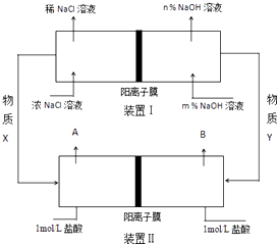
��1����ⱥ��ʳ��ˮ���ȼҵ���Ļ�ѧ����ʽΪ ��
��2������XΪ �� װ�â�͢�������ȼ�ϵ�ص��� ��
��3��װ�â��У�NaOH��ҺŨ��m%n% ���������������
��4������װ�â�ɻ��10mol/L���ᣬ�ò�Ʒ����Ϊ���A����B��������˵������ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com