
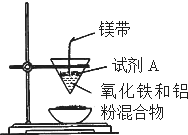
 某小组进行铝热反应实验,装置如图所示.
某小组进行铝热反应实验,装置如图所示.| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| 2 | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
| B、将磁性氧化铁溶于盐酸中:Fe3O4+8H+═3Fe3++4H2O |
| C、向硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O |
| D、将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜粉和硫粉混合加热可制得CuS |
| B、久置酸雨酸性增强,原因是水的挥发 |
| C、加热经SO2漂白的品红试液,颜色不变 |
| D、SO2通人含有大量H+的KMnO4溶液中,溶液褪色,体现了SO2的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g?cm-3 | 难溶于水,易溶于醇、醚等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫与水反应生成硫酸 |
| B、二氧化硫是酸性氧化物,能被氨水吸收 |
| C、二氧化硫是有毒气体,不能用于杀菌消毒 |
| D、正常雨水的pH为5.6,因为其中溶解了二氧化硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com