
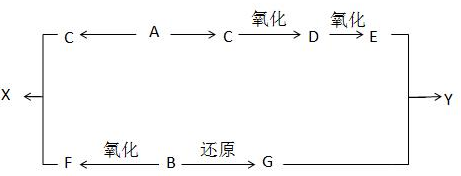
分析 (1)若X为氧气,A为短周期元素的单质,A能连续与氧气反应,应为变价元素,如C、S、N等对应的单质,也可能为Na;
(2)若X为氧气,A在通常情况下为气态氢化物,且能使酚酞试液变红,则A为NH3,B为NO,C为NO2;
(3)若X为强碱,B为白色胶状沉淀,则A为铝盐,B为Al(OH)3,C为偏铝酸盐.
解答 解:(1)若X为氧气,A为短周期元素的单质,A能连续与氧气反应,应为变价元素,氧气和铝反应生成的氧化物不能再和氧气反应,可以为碳、氮气、硫、钠,故答案为:⑤;
(2)若X为氧气,A在通常情况下为气态氢化物,且能使酚酞试液变红,则A为NH3,B为NO,C为NO2,A转化为B的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:NH3;4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)若X为强碱,B为白色胶状沉淀,则A为铝盐,B为Al(OH)3,C为偏铝酸盐,A转化为B的离子方程式 为:Al3++3OH-═4Al(OH)3↓,氢氧化铝可以用于治疗胃酸过多,
故答案为:Al3++3OH-═4Al(OH)3↓;治疗胃酸过多.
点评 本题考查无机物推断,涉及C、N、S、Na、Al元素单质化合物的性质,主要考查物质连续反应的特征,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-=3Fe3++NO↑+4H2O | |
| D. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用催化措施,将汽车尾气中的CO和NO转化为无害气体 | |
| B. | 合金材料中不可能含有非金属元素 | |
| C. | 信息产业中的光缆的主要成分是单质硅 | |
| D. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
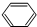 .
. +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$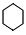
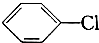 :
: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S | B. | O2 | C. | H2S、SO2 | D. | SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
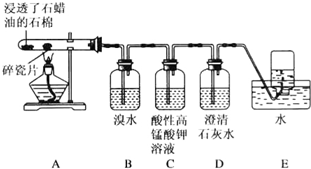
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
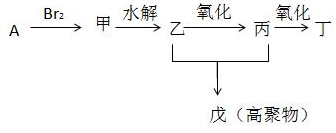
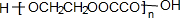
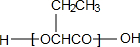 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,氨水溶液加水稀释,$\frac{c(N{H}_{2}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| B. | 2SO2(g)+O2 (g)?2SO3(g)(△H<0),其它条件不变时,升高温度,v(正)增大、v(逆)减小,平衡正向移动 | |
| C. | 某容器中存在H2(g)+I2 (g)?2HI(g)反应,当减小容器体积时,气体颜色加深,各物质的百分含量不变 | |
| D. | 25℃时Mg(OH)2的Ksp小于MgF2的Ksp,则饱和Mg(OH)2与饱和MgF2相比,前者c(Mg2+)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com